Tema 6. Enlla qumic
(pg
122 a 141 del llibre de text Qumica I. Edeb)
del full: 10 enlla.doc
del full: 05 enllaç
PAU.doc
vid : 10 enlla solucions.doc
VEURE: http://web.educastur.princast.es/ies/salinas/recursos/Equimico.htm
(bones explicacions i bons grfics interactius del tema)
1)
Per qu els toms tendeixen a cedir, captar o
compartir electrons? Quin estat volen assolir?
2)
Per qu els gasos nobles (o inerts) no tenen
tendncia a cedir, captar o compartir electrons?
3)
Qu postula la regla de l'octet? Serveix per
interpretar tots els enllaos?
4)
a)En el procs en que dos toms s'apropen per
formar un enlla explica en quina fase dominen les forces atractives? En quina
fase dominen les forces repulsives?
b) Qu ocasiona l'atracci? , i la repulsi?
c) Quan es dna la situaci d'equilibri entre els
dos toms?
d) Encercla la resposta correcta :
Quan s'aproximen dos toms d'hidrogen, per exemple,
apareixen simultniament forces d'atracci i repulsi. Al final es forma una
agrupaci estable, la molcula d'H2 ,
el procs ve acompanyat de [ desprendiment / absorci ] d'energia, es
l'anomenada [ energia reticular / energia d'enlla / energia potencial ]. Per
separar els toms un cop formada la molcula haurem de comunicar-los [ la
mateixa / menor / semblanta ] quantitat d'energia.
5)
El Na s un element molt electropositiu. El Cl s
molt electronegatiu. Els seus nombres atmics sn Z(Na)= 11, Z(Cl) =17
a) Escriu les configuracions electrniques.
Explica el perqu del seu carcter electropositiu i lectronegatiu. Quins seran
els ions probables del Na i el Cl?
b) Explica pas a pas com s'enllaaran els atoms
de Na amb els de Cl? Com s'anomena aquest enlla?
c) "Enlla inic" ve d'i, Per qu?
d) Els ions del Na i el Cl, queden units, o
millor dit, enllaats per acci de: (assenyala la millor resposta)
[ ]
els electrons compartits [ ] la fora d'enlla [
] atracci electrosttica [ ] l'energia reticular
6)
La frmula del clorur sdic s NaCl (enlla
inic). La del oxigen s O2 (enlla covalent). Per qu s possible l'existncia de
molcules individuals d'O2 i en canvi no existeixen molcules individuals de NaCl?
7)
Assenyala les propietats de les substncies
iniques i el perqu d'aquesta propietat:
a) Les substncies iniques sn majoritriament [
slides/lquides/ gasoses ] perqu ...
b) Les substncies iniques sn [ dures / toves ]
perqu ...
c) Les substncies iniques tenen una temperatura
de fusi i ebullici [ alta / baixa ] perqu ...
d) En general es dissolen [ b / malament ] en
dissolvents polars com l'aigua perqu ...
e) En estat slid la seva conductivitat elctrica
s [ molt alta / molt baixa ], mentre que en dissoluci la seva conductivitat
elctrica s [ molt alta / molt baixa ] perqu ...
8)
Digues si es vertader o fals:
L'enlla covalent es produeix:
[
] entre dos elements de marcat caracter metlálic
[
] entre dos elements de
molt electronegatius
[
] entre dos elements que volen agafar electrons
[
] entre un element que vol agafar e- i un altre que vol cedir
[
] entre dos elements que comparteixen electrons
[
] en la molcula d'H2
[
] entre Na i Na
full: Carga
Formal.doc
Qu s la Crrega formal
http://www.fq.uh.cu/dpto/qg/geografia/quimica/enlaces.htm
Carga Formal = Nmero de electrones de - (
electrones no + 1 Ú 2 electrones )
valencia en el
tomo compartidos
compartidos
Ejemplo 1
Estructura de Lewis del CO2
Electrones de valencia del
C 1 x 4 = 4
Electrones de valencia del O 2 x 6 =
12
Total de electrones a
representar 16
Valencia del C: 4
Valencia del O: 2
O = C = O
Carga Formal C = 4 –( 0 + 1Ú2 (8)) = 0
Carga Formal O = 6 – ( 4 + 1Ú2 (4)) = 0
9)
Dibuixa les estructures de Lewis de:
a) H2
b) H2O
c) NH3
d) H Cl
e) CH4
Ara apareixeran enllaos dobles o triples
f) CO2
g) CS2
h) HCHO
i) H3PO4
j) HCN
k)--
l)
--
ll) C2H2 (
et o acetil)
m) C2H6 O (etanol)
n) HCOOH (cid metanic , tamb, cid frmic)
)
CH3COCH3 (propanona , tamb, acetona)
o) CH3COOH (cid etanoic)
Estructures de Lewis amb ions
Del full: 07 Lewis ions.doc
Com fer les estructures de Lewis dÕespcies iniques
El proces s el mateix.
Simplement sÕha de tenir en compte el segent:
.a) En al cas dÕanions:
sÕha
de sumar 1 electr per cada crrega
negativa de lÕani en el clcul de v (e- de capa)
.b) En al cas de cations:
sÕha
de restar 1 electr per cada crrega
postiva del cati en el clcul de v (e- de capa)
Vegem un exemple:
Dedueix lÕestructura de Lewis i la forma geomtrica de lÕani sulfit SO32-
S
n = 8 v = 6
O
n = 8 v = 6 n
= 1 x 8 + 3 x 8 = 32 e-
v
= 1 x 6 + 3 x 6 + 2 e- = 26 e-
c
= n – v = 32 – 26 = 6 e-
(3 enllaos)
s
= v – c = 26 – 6 = 20 e-
(10 parells no enllaants)
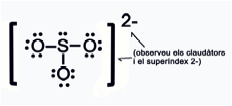
La seva geometria dÕacord
amb RPENV
Ser PIRAMIDAL TRIGONAL
Activitats
1) Dedueix lÕestructura de Lewis i la forma geomtrica de lÕani clorat ClO3-
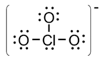 soluci
soluci
2) Dedueix lÕestructura de Lewis i la forma geomtrica de lÕani
carbonat CO32-
3) Dedueix lÕestructura de Lewis i la forma geomtrica del cati nitroni
NO2+
(soluci: N amb dos
dobles enllaos i geometria linial)
Formes
ressonants
10)
a) Qu sn les formes ressonants d'una espcie
qumica ?
b) Escriu les tres formes ressonants de l'ani
carbonat CO32-
c) Qu una espcie qumica presenti ressonncia
li proporciona ms estabilitat? Per qu?
11)
Escriu les estructures de Lewis i les formes
ressonants de les espcies qumiques segents:
a) CH3COO–
b) NO3–
c) SO2
12)
a) Ëtoms de carboni, en estat gass, s'uneixen
per formar un enlla covalent. En aquest procs s'alliberen 82,8 kcal per cada
mol d'enllaos formats. Com s'anomena aquesta quantitat?
b) Quanta energia s necessria donar a l'enlla
C-C per trencar-lo ?
13)
En la molcula d'hidrogen la distncia promig
entre els dos nuclis atmics dels toms
s de 0,37 Angstrom.
a) Com s'anomena aquest parmetre?
b) Qu s un Angstrom ? Quin s el seu simbol?
c) Per qu es parla de distncia promig entre els nuclis?
14)
a) L'angle d'enlla s tamb un promig? Per qu?
b) Quin s l'angle d'enlla de la molcula
d'hidrogen?
Polaritat
dÕenlla i de la molcula.
En general als alumnes els costa raonar
correctamentsi una molcula s polar o no. Alguns noms posen un dibuix i no
expliquen res ms.
Aqu us mostrem alguns exemples de com es pot
justificar de forma breu si la molcula es polar o apolar. Cal raonar-ho amb
paraules i amb el refor dÕun senzill dibuix.
Preneu nota:
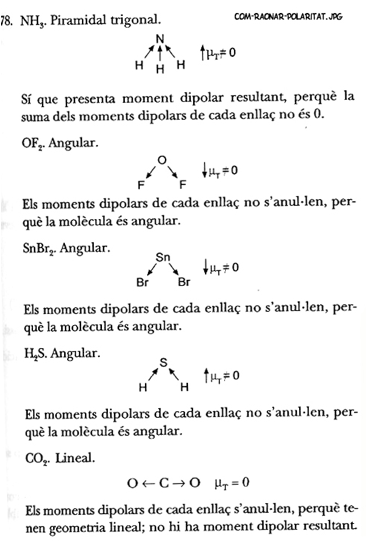
NOTA:
mT s el moment dipolar resultant
15)
Qu s la polaritat d'un enlla:
[ ]
La diferent electronegativitat dels toms que enllacen.
[ ]
El nuvol electrnic que hi ha entre els toms que enllacen
[ ]
El fenomen que fa que es deplaci el nuvol electrnic sobre l'tom ms
electronegatiu
[ ]
El fenomen responsable de les prpietats magntiques d'alguns materials
16)
a) El Flour s l'element ms electronegatiu de la
taula. Per qu l'enlla F-F no s polar, com per exemple en la molcula d'F2 .
b) Busca les electronegativitats a la taula
peridica i ordena de major a menor polaritat les segents molcules: HF, HCl,
HBr, HI.
17)
Quina diferncia hi ha entre "polaritat
d'enlla" i "polaritat de la molcula"
18)
El CO2 s
una molcula lineal.
a) T moment dipolar l'enlla C=O?
b) T moment dipolar resultant la molcula de CO2 ?
19)
a) Que volen dir les sigles RPENV? (tamb VSEPR)
b) Quina utilitat t el mtode RPENV?
c) Que sn els parells d'electrons de la capa de
valncia?
d) El mtode RPENV diu que els parells d'electrons
de la capa de valencia es coloquen entorn a l'tom central de forma que la seva
separaci sigui [ mxima, mnima, intermitja ?] i per tant les repulsions
siguin [ mximes, mnimes, adequades ?].aquesta disposici determina
l'ordenaci dels altres toms de la molcula entorn l'tom central.
20)
a) Fes l'estructura de Lewis del NH3 i justifica la seva geometria. Z (N)
= 7 Z(H) = 1
b) Fes l'estructura de Lewis del BF3 i justifica la seva geometria. Z (B)
= 5 Z(F) = 9
c) Per qu t moment dipolar la molcula de NH3 i en canvi la molcula de BF3 s apolar?
21)
Justifiqueu la geometria i la polaritat de la
molcula d'aigua. Z (O) = 8 Z(H) =
1
22)
Segons el mtode RPECV el met CH4 t una geometria tetradrica, amb
angles H-C-H de 109,5o, que sn els normals d'un tetraedre. El NH3 que tamb t geometria tetradrica t
l'angle H-N-H una mica ms tancat (107o) Per qu succeix aix?
23)
a)Com expliques l'angle de 104o (H-O-H) de l'aigua, tan allunyat dels
109,5o normals
d'un tetraedre?
b) Creus que l'aigua ser una molcula molt
polar? Per qu?
24)
El H2S s una molcula de la mateixa geometria que el
H2O.
a) Justifica quin enlla s ms polar el H-O o el
H-S
b) Justifica quina de les dos molcules tindr un
moment dipolar ms alt.
c) Qu un enlla A-B sigui polar significa que la molcula A-B-A ha ser polar
sempre? Posa un exemple en que A-B-A sigui polar i un altre en que A-B-A sigui
apolar:
d) Perqu el nitrogen (N2 ) s poc soluble en aigua i en canvi l'amonac (NH3 ) si que ho s?
25)
L'enlla per pont d'hidrogen s:
a) [
] Una atracci electrosttica
[ ] Una compartici
d'electrons [ ] Una uni entre toms
b) [
] Un enlla entre molcules
[ ] Una interacci entre
molcules
26)
a)
L'enlla per pont d'hidrogen s'origina en la densitat de carga positiva(
¶+) que
hi ha sobre l'hidrogen. Qu causa aquesta ¶+?
b) Quines dues caracterstiques han de complir
els toms que estiguin enllaats amb l'hidrogen perqu s produeixi un pont
d'hidrogen?
c) L'enlla C-H no s adequat per donar ponts
d'hidrogen en molcules com el CH4. Per qu?
27)
L'aigua (H2O) hauria de ser gas a temperatura
ambient si la comparem amb compostos similars com el H2S i el H2Se. Ara b,
com ja sabeu, s lquida i aix s ms aviat una anomalia. Qu fa que l'aigua
sigui liquida a temperatura ambient i a ms amb un punt d'ebullici
relativament alt (100oC)?
28)
Creus que el fluorur d'hidrogen (HF) presenta un
enlla per pont d'hidrogen m acusat que l'aigua (H2O)? Justifica-ho.
29)
Les moleculars apolars, com el Br2, poden tenir algun tipus d'atracci
electrosttica entre elles. Com s'anomena i com s'originen els dipols?
30)
La intensitat de les forces de dispersi o de Van
der Waals augmenta amb el tamany de la molcula o tom? D'acord amb aquest
criteri justifica perqu el punt de fusi dels gasos nobles augmenta cap avall
en el grup.
31)
a) Justifica perqu el fluor (F2 ) i el clor (Cl2 ) sn gasos, el brom(Br2 ) s lquid i el iode (I2 ) s slid?
b) Busca que s la sublimaci? Per qu sublima el
iode?
32)
a) Quines forces s'han de vencer per passar aigua
lquida a vapor?
b) Quina creus que s una atracci ms forta:
l'atracci electrosttica dels ions d'una xarxa inica , com la sal, o els
ponts d'hidrogen de l'aigua?
c) Creus que en general les substancies
moleculars covalents tindran punts d'ebullici alts? Justifica-ho.
33)
Les substncies covalents sn molt diferents. El
brom (Br2 ) s una substncia molecular,
existeixen molcules de Br2 de forma
individual, el seu estat s lquid en condicions ambient. El carboni (C) o el dixid de silici
(SiO2 ) tot i ser susbtncies amb enlla
covalent no existeixen com a molcules individuals sin que formen grans xarxes
macromoleculars.
a) Perqu aquests slids macromoleculars sn els
slids ms durs que s coneixen. (recorda que el diamant s carboni pur)?
Nota: El SiO2 ,tamb silice, s un dels components principals de la sorra
de la platja.
b) Quina creus que s ms forta l'atracci
electrosttica d'una xarxa inica (NaCl) o l'enlla covalent d'un slid
covalent macromolecular (SiO2 )?
ENLLA PAU
del full: 05 enllaç PAU.doc
vid: SOLS tifs
05 Enllaç PAU vid:
05 enllaç PAU sols .doc VID:
PAUEnlace
vid: PAUEnlace
Galicia vid:
rough.doc (activ. PosaÕt)
34) set 06
- opci B- 4.
L'alcohol etlic (etanol) es un bon combustible que
reacciona amb l'oxigen i dna dixid de carboni i aigua.
a) Escriviu la reacci de combusti de l'alcohol etlic i
establiu les estructures de
Lewis dels reactius i dels productes de la combusti.
[1 punt]
(pregunta de termoqumica)
b) Calculeu la variaci d'entalpia estndard a 25 ¡C d'aquesta reacci
fent servir les energies estndard d'enlla a 25 ¡C que s'indiquen a
continuaci: [1 punt]
Enlla
C-C C-H C-O O-H O=O C=O
Energia / kJ mol-1 413,4 414,0 351,0 462,8 401,7 711,3
Dades: nombres atmics: H: Z = 1 ; C:
Z = 6; 0:
Z = 8
35) 2) Juny06 serie 1-0pcio A. 5.
Aplicant la teoria de la repulsi dels pareils d'electrons
de la capa de valncia, establiu la geometria de les molcules segents:
a) CF4
NF3 i BF3.
[0,75
punts]
b) Raoneu en cada cas si la molcula sera polar o
apolar. [0,45
punis]
(pregunta dÕcid-base)
c) Definiu cid i base de Lewis i raoneu si alguna de les molcules
indicades en ll'apartat
a) podr actuar d'cid o de base de Lewis.
[0,8
punts]
Dades: nombres atmics: B; Z=5 C; Z=6 N; Z=7 F; Z=9
36)
3) OPCIî A SéRIE 1 pau_quim05jl 5.
a) Representeu les estructures de Lewis dels elements
nitrogen, oxigen i clor.
[0,5
punts]
b) DÕacord amb la teoria de la repulsi dels parells dÕelectrons de valncia,
justifiqueu les estructures i la geometria de les molcules NCl3, Cl2O i NO,
i indiqueu, a ms a ms, el tipus dÕenlla que es forma i si les molcules sn
polars o no. [1,5 punts]
Dades:
nombres atmics: N = 7, O = 8, Cl = 17
37) 4) OPCIî A SéRIE 5 pau_quim04sl
5.
Justifiqueu, a partir de les estructures electrniques de valncia (o de
Lewis), quina s la geometria ms probable de les molcules segents i indiqueu
tamb si tindran carcter polar o no:
a) CHCl3
[0,5
punts]
b) CBr4
[0,5
punts]
c) Cl2O
[0,5
punts]
d) NH3
[0,5
punts]
Dades: nombres atmics: H = 1; C = 6; N = 7; O = 8; Cl = 17;
Br = 35
38)
5) OPCIî B SéRIE 1 PAU. pau_quim04jl
4. Justifiqueu, a partir de les estructures electrniques de
valncia (o de Lewis), quina s la geometria ms probable de les molcules
segents, i indiqueu tamb si tindran carcter polar o no:
a) BF3 [0,5
punts]
b) NF3 [0,5
punts]
c) CO2 [0,5
punts]
d) H2S [0,5
punts]
Dades: nombres atmics: H = 1; B = 5; C = 6; N = 7; O = 8; F
= 9; S = 16
39)
6) OPCIî A SéRIE 5 PAU. pau_quim03jl
.5. La
configuraci electrnica de la capa de valncia dÕun element qumic en lÕestat
fonamental s 4s24p5.
a) Indiqueu
quin s el nombre atmic dÕaquest element, aix com el grup i el perode als
quals pertany, justificant adequadament les respostes. [1 punt]
b) En combinaci amb el
fsfor, aquest element forma un compost de frmula PX3.
Justifiqueu quina geometria presentar una molcula dÕaquest compost. [1 punt]
Dades:
nombre atmic del fsfor: 15
40)
7) OPCIî A SéRIE 1 pau_quim02sl
4. Els smbols 12 6C 14 6C corresponen a dos
tipus dÕtom de carboni.
a) Indiqueu quin nom reben aquests tipus dÕtoms i en
qu es diferencien. [0,5 punts]
.b) Doneu la configuraci electrnica dels toms
anteriors en el seu estat fonamental. [0,5 punts]
.c) Indiqueu quin s el compost estable ms senzill
que formen el carboni
i el clor (nombre atmic = 17) i justifiqueu la
geometria que tindr la molcula. Esmenteu tamb algun altre compost que tingui
la mateixa geometria. [1 punt]
PosaÕt a prova ENLLA. Qestions curtes
full: 06 posat ENLLAÇ.doc
41) En
la molcula de triclorur de fsfor, el fsfor est envoltat de quatre parells
d'electrons. Per tant, com ha de ser la geometria d'aquesta molcula?
A) tetradrica
B) piramidal
C) triangular
D) bipiramidal
42) 2)
Una molcula diatmica:
A) sempre t carcter polar.
B) noms s polar si els dos toms sn
diferents.
C) noms s polar si els dos toms sn iguals.
D) no pot ser polar, perqu no pot tenir
estructura angular.
43) 3)
En relaci a la teoria de l'enlla, indiqueu la proposici correcta
A) la molcula de CO2 s polar degut
a les estructures ressonants
B) la molcula de PCl3 t una
geometria piramidal
C) l'amonac t carcter cid ja que posseeix un
parell d'electrons sense compartir
D) la polaritat del CCl4 es deguda a la
diferncia d'electronegativitats entre el clor i el carboni
44) 4)
En relaci a la teoria de l'enlla indiqueu la proposici correcta:
A) la geometria de la molcula de PCl3 s plana
triangular
B) el moment dipolar de la molcula de BeCl2 s zero ja que
es tracta d'una molcula lineal i simtrica
C) l'amonac presenta un comportament d'cid de
Lewis donat que t un parell d'electrons sense compartir
D) la polaritat del CH4 es deguda als
enllaos per pont d'hidrogen
45) 5)
Pel que fa a les molcules de H2O, CO2, BF3 i NH3 podem dir que
A) totes elles sn polars
B) els enllaos de totes elles sn polars per
les molcules tenen un moment dipolar nul per raons de geometria
C) l'H2O s polar, la resta no
D) l'H2O i el NH3 sn polars, mentre que la resta no ho sn
46) 6) Quina de les segents molcules no presenta moment dipolar?
A) CO2
B) NH3
C) HCl
D) H2O
47) 7)
Donats els segents compostos: H2O, NH3 , CH3 -O-CH3 i PH3 , indiqueu en quins d'ells s'estableixen
enllaos d'hidrogen (pont d'hidrogen)
A) H2O, NH3 , CH3 -O-CH3 i PH3
B) H2O, NH3 i PH3
C) H2O i PH3
D) H2O i NH3
48) 8)
Tant la molcula de l'aigua (H2O) com la del dixid de carboni (CO2) estan
formades per tres toms i
A) ambdues tenen geometria lineal
B) ambdues tenen geometria angular
C) la molcula d'aigua s lineal i la del dixid
de carboni s angular
D) la molcula d'aigua s angular i la del
dixid de carboni lineal
49) 9)
El sulfur d'hidrogen s un gas en condicions normals, mentre que l'aigua s'ha
d'escalfar
fins a 100 ¼C (1 atm) per a qu entri en
ebullici. A qu s degut aix?
A) perqu la massa molar de l'aigua s menor
B) perqu l'enlla S-H s ms feble que el O-H
C) perqu a l'aigua hi ha enllaos d'hidrogen
molt intensos
D) cap de les respostes anteriors
50) 10)
Indiqueu quins dels compostos segents sn gasos a temperatura ambient i 1 atm
de pressi:
1. HCl
2. CO2
3. I2
4. KCl
5. NH3
A) 2 i 5
B) 2, 3 i 5
C) 1, 2 i 5
D) 1, 2 i 4