Estructures de Lewis amb ions
Com fer les estructures de Lewis d’espècies iòniques
El proces és el mateix. Simplement s’ha de tenir en compte el següent:
.a) En al cas d’anions:
s’ha de sumar 1 electró per cada càrrega negativa de l’anió en el càlcul de v (e- de capa)
.b) En al cas de cations:
s’ha de restar 1 electró per cada càrrega postiva del catió en el càlcul de v (e- de capa)
Vegem un exemple:
Dedueix l’estructura de Lewis i la forma geomètrica de l’anió sulfit SO32-
S n = 8 v = 6
O n = 8 v = 6 n = 1 x 8 + 3 x 8 = 32 e-
v = 1 x 6 + 3 x 6 + 2 e- = 26 e-
c = n – v = 32 – 26 = 6 e- (3 enllaços)
s = v – c = 26 – 6 = 20 e- (10 parells no enllaçants)
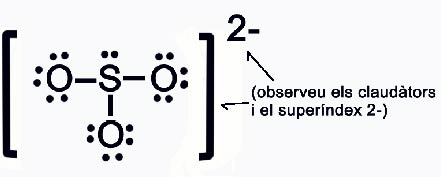
La seva geometria d’acord amb TRPECV
Serà PIRAMIDAL TRIGONAL
Activitats
1) Dedueix l’estructura de Lewis i la forma geomètrica de l’anió carbonat CO32-
(solució en pag 49 del llibre de text)
2) Dedueix l’estructura de Lewis i la forma geomètrica de l’anió clorat ClO3-
(solució en pag 49 del llibre de text)
3) Dedueix l’estructura de Lewis i la forma geomètrica del catió nitroni NO2+
(solució: N amb dos dobles enllaços i geometria linial)