Termoquímica PAU
1) set 06- opcio B- 4. L'alcohol etílic (etanol) és un bon combustible que reacciona amb l'oxigen i dóna dióxid de carboni i aigua.
a) Escriviu la reacció de combustió de l'alcohol etílic i establiu les estructures de
Lewis dels reactius i dels productes de la combustió. [1 punt]
b) Calculeu la variació d'entalpia estàndard a 25 °C d'aquesta reacció fent servir les energies estàndard d'enllaç a 25°C que s'indiquen a continuació: [1 punt]
Enllaç C-C C-H C-O O-H O=O C=O
Energia / kJ mol-1 413,4 414,0 351,0 462,8 401,7 711,3
Dades: nombres atómics: H: Z = 1 ; C: Z = 6; 0: Z = 8
Sol: b) – 1120 kJ mol-1
2) SÈRIE 4 pau_quim05jl
3. Les entalpies estàndard de formació del butà, l’aigua líquida i el diòxid de carboni són, respectivament, –124,7, –285,5 i –393,5 kJ · mol–1.
a) Escriviu la reacció de combustió del butà. [0,5 punts]
b) Calculeu l’entalpia estàndard de combustió del butà. [0,5 punts]
c) Trobeu la quantitat d’energia calorífica que s’obté en cremar tot el butà d’una bom-bona (12,5 kg). [0,5 punts]
d) Si aquesta energia s’utilitza per escalfar aigua des de 10 °C fins a 40 °C, calculeu la quantitat d’aigua calenta que es podria obtenir. [0,5 punts]
Dades: masses atòmiques: H = 1, C = 12 capacitat calorífica de l’aigua: 4,18 kJ · kg–1 K–1
Sol: a) b) -2876 kJ mol-1 c) 6,20·105 kJ d) 4944 kg H2O
3) OPCIÓ B pau_quim05sl
4. La hidrazina (N2H4) reacciona amb el peròxid d’hidrogen (H2O2) segons l’equació:
N2H4 (l) + 2 H2O2 (l) ------- > N2 (g) + 4 H2O (l)
a) A partir dels valors de la taula següent, calculeu la variació d’entalpia estàndard i la variació d’entropia estàndard del procés a 25 °C. [1 punt]
|
|
N2H4 (l) |
H2O2 (l) |
N2 (g) |
H2O (l) |
|
∆Hf ° / kJ · mol–1 |
50,63 |
–187,78 |
0 |
–285,83 |
|
S° / J · K–1mol–1 |
121,21 |
109,6 |
191,61 |
69,91 |
b) Justifiqueu si la reacció serà espontània a 25 °C en condicions estàndard. [0,5 punts]
c) Aquesta reacció s’ha utilitzat de vegades en la propulsió de coets. Calculeu la quantitat d’energia produïda a partir d’1 kg d’hidrazina. [0,5 punts]
Dades: masses atòmiques: H = 1, N = 14, O = 16
Sol: a) - 818,4 kJ mol-1 130,84 J K-1mol-1 b) DGº = -857,4 kJ mol-1 c) 27280 kJ
4) SÈRIE 5 pau_quim04sl
2. L’acetilè (C2H2) s’obté fent reaccionar el carbur de calci (CaC2) amb aigua, segons la reac-ció:
CaC2 (s) + 2 H2O (l) ------ > C2H2 (g) + Ca(OH)2 (s),
en la qual es desprenen 270,7 kJ per mol de CaC2.
a) Trobeu l’entalpia de formació de l’acetilè. [0,5 punts]
b) Escriviu la reacció de combustió de l’acetilè i determineu la variació d’entalpia estàn-dard per a aquesta reacció. [1 punt]
c) Calculeu la calor que es desprèn quan es crema l’acetilè obtingut a partir de 6,4 g de carbur de calci. [0,5 punts]
Dades: masses atòmiques: H = 1; C = 12; O = 16; Ca = 40
|
|
Ca(OH)2 |
H2O (I) |
CaC2 (s) |
CO2 (g) |
O2 (g) |
|
∆H 0 f /kJ · mol–1 |
–986 |
–286 |
83 |
–395,5 |
0,0 |
Sol: a) 226,3 kJ mol-1 b) -1303,3 kJ mol-1 c) 130,3 kJ mol-1
5) SÈRIE 4 pau_quim04ll 2
3. Per a la reacció en fase gasosa que té lloc entre el clorur d’hidrogen i l’oxigen, en condi
cions d’equilibri:
4 HCl (g) + O2 (g) --------- > 2 H2O (g) + 2 Cl2 (g)
.a) Calculeu la variació d’energia interna a 298 K. [1 punt]
Qüestions d’equilibri
.b) Justifiqueu com afectarà a l’equilibri un increment de la pressió total del sistema. [0,5 punts]
.c) Justifiqueu quin efecte tindria sobre l’equilibri un augment de la temperatura a la qual té lloc la reacció. [0,5 punts]
Dades: ∆H0 (HCl (g)) = –92,30 kJ · mol–1; ∆H0 (H2O (g)) = –241,8 kJ · mol–1
R = 0,082 atm · L · K–1 · mol–1 = 8,31 J · K–1 · mol–1
SOL: a) -111,9 kJ mol-1
6) OPCIÓ A SÈRIE 1 PAU. pau_quim04jl
5. La gràfica següent representa la variació amb la temperatura del ∆G0 d’una reacció:
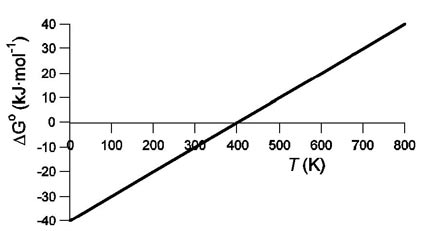
Suposant que els valors de ∆H 0i ∆S 0 de la reacció són constants en tot l’interval de tem-peratures de la gràfica i considerant la reacció en condicions estàndard:
.a) Doneu l’expressió del ∆G0 de la reacció en funció de ∆H0i ∆S0 i trobeu a quina tem
peratura estem en condicions d’equilibri. [0,5 punts]
.b) Citeu una temperatura en la qual la reacció sigui espontània. [0,5 punts]
.c) Trobeu el valor del ∆H0 de la reacció i digueu si aquesta és exotèrmica o endotèrmica. [0,5 punts]
.d) Justifiqueu si la variació de l’entropia de la reacció és positiva o negativa. [0,5 punts]
SOL: a) T=400K b) c) –40 kJ · mol–1 d)
7) SERIE 3 pau_quim04jl
2. L’equació termoquímica corresponent a la reacció de neutralització en una dissolució aquo-sa és:
H+(aq) + OH– (aq) ------------- > H2O (l) ∆H0 = –54 kJ · mol–1
a) Trobeu quina quantitat de calor correspon a la neutralització de 25 cm3 d’àcid clorhídric 2 M amb 25 cm3 d’hidròxid de sodi 2 M. [0,5 punts]
b) La dissolució s’escalfarà o es refredarà? [0,5 punts]
c) Si la massa de la dissolució anterior és de 52 g i estava a 20 °C, calculeu la tempe-ratura final de la dissolució. [1 punt]
Dada: capacitat calorífica de l’aigua: 4,18 J · g–1K–1
SOL: a) 2,7 kJ b) c) T = 32,4ºC
8) SÈRIE 3 pau_quim03sl
3. La fabricació industrial de l’àcid nítric requereix una oxidació catalítica prèvia de l’amoníac, d’acord amb la reacció:
4 NH3 (g) + 5 O2 (g) ------ > 4 NO (g) + 6 H2O (g)
.a) Calculeu la variació d’entalpia estàndard de la reacció a 25 °C. [0,5 punts]
.b) Calculeu la variació d’entropia estàndard de la reacció a 25 °C. [0,5 punts]
.c) Determineu a partir de quina temperatura la reacció tindrà lloc espontàniament en el
sentit indicat si totes les espècies estan en el seu estat estàndard. [0,5 punts]
.d) Justifiqueu cap a on es desplaçarà l’equilibri si augmenta la pressió total del sistema. [0,5 punts]
Dades:
|
|
NH3 (g) |
O2 (g) |
NO (g) |
H2O (g) |
|
∆H 0 f / kJ · mol–1 |
–46,11 |
0 |
90,25 |
–241,82 |
|
S° / J · K–1 · mol–1 |
192,45 |
205,14 |
210,76 |
188,83 |
SOL: a) –905,48 kJ · mol–1 b) 180,52 J K-1mol-1 c) d)
9) SÈRIE 5 PAU. pau_quim03jl
.2. El diòxid de sofre és un dels gasos que s’emeten com a conseqüència de la combustió d’hidrocarburs fòssils. Per reacció amb l’oxigen atmosfèric pot transformar-se en triòxid de sofre (gas).
a) Si les entalpies estàndard de formació del diòxid de sofre i del triòxid de sofre són, respectivament, –297 i –395 kJ · mol–1, calculeu la variació d’entalpia corresponent a aquesta reacció. És un procés exotèrmic o endotèrmic? [0,5 punts]
.b) Calculeu la variació d’energia interna a 25 °C d’aquest procés. [1 punt]
c) Trobeu la quantitat de calor intercanviada a pressió constant quan es formen 30 litres de triòxid de sofre, mesurats a 25 °C i 1 atm. [0,5 punts]
Dades: R = 0,082 atm · L · K–1 · mol–1 = 8,31 J · K–1 · mol–1
SOL: a) ∆H = –98 kJ · mol–1 b) ∆U = –96,76 kJ · mol–1 c) 120,54 kJ
10) SÈRIE 2 pau_quim02jl
2. Les variacions d’entalpia estàndard per a les reaccions de combustió de l’etanol i de l’etè a 298 K són, respectivament, –1367 kJ · mol–1 i –1411 kJ · mol–1.
.a) Escriviu les reaccions de combustió d’aquests dos compostos. [0,6 punts]
.b) Determineu la variació d’entalpia de la reacció que té lloc entre etè i aigua per donar etanol. [0,6 punts]
.c) Calculeu, de la reacció anterior, la variació d’energia de Gibbs estàndard a 298 K i
indiqueu si la reacció (en condicions estàndard) serà espontània en el sentit indicat. [0,8 punts]
Dades: S0(etè(g)) = 219,5 J · K–1mol–1
S0(H2O(l)) = 69,91 J · K–1mol–1
S0(etanol(l)) = 160,7 J · K–1mol–1
SOL: a) b) –44 kJ · mol–1 c) –4,6 kJ · mol–1
10)b Feu el problema número 34 de la pàgina 93 del llibre de text. És una aplicació de la Llei de Hess però amb una mica de complicació matemàtica per calcular la combinació de les equacions.
11) OPCIÓ A SÈRIE 3 pau_quim02jl
5. El clorat de potassi es descompon en clorur de potassi i oxigen. Les entalpies estàndard de formació del clorur de potassi i el clorat de potassi a 25 °C són, respectivament, –437 kJ · mol–1 i –398 kJ · mol–1.
.a) Escriviu la reacció corresponent a la descomposició. [0,5 punts]
.b) Calculeu la variació d’entalpia de la reacció i indiqueu si aquesta és exotèrmica o endotèrmica. [0,5 punts]
.c) Raoneu quin serà el signe de la variació d’entropia estàndard de la reacció. [0,5 punts]
.d) Justifiqueu si la reacció serà o no espontània en condicions estàndard. [0,5 punts]
SOL: a) b) –39 kJ · mol–1
12) SÈRIE 2 02-S2.doc
.3. De manera aproximada, la benzina es pot considerar composta per una mescla equimo-lecular d’octà i nonà.
.a) Escriviu les reaccions de combustió dels esmentats hidrocarburs. [0,5 punts]
.b) Calculeu el volum d’aire en condicions normals que es necessita per cremar 484 g de benzina.[1 punt]
.c) Calculeu la calor alliberada en aquesta combustió si té lloc a pressió constant. [0,5 punts]
Dades: masses atòmiques: C = 12, O = 16, H = 1.
Composició aire: 20% d’oxigen en volum.
Entalpies de combustió: octà: – 5471 kJ · mol–1 ; nonà: – 6120 kJ · mol–1.
R = 0,082 atm · L · K–1mol–1.
SOL: a) b) 5932,5 dm3 c) 23182 kJ