11 acid base.doc
Àcid-base. PAU
1) set 06.
3. A 25 °C es té una dissolució 0,100 M d'àcid acètic en la qual l'àcid es troba ionitzat un 1,3%.
a) Calculeu el pH d'aquesta dissolució. [0,4 punts]
b) Calculeu el valor de Ka a 25 °C. [0,4 punts]
c) Calculeu el volum d'una dissolució 0,250 M d'hidròxid de potassi necessari
per valorar 50 mL de la dissolució d'àcid acètic. [0,4 punts]
d) Detallant el procediment seguit, els materials i l'indicador emprats, expliqueu corn fareu al laboratori la valoració de l'apartat anterior. [0,8 punts]
SOLS: a) 2,89 b) 1,71 · 10-5 c) 0,020 L
2) Juny06 serie 1
2) Es disposa d’una solució d’hidròxid de potassi del 2,380% en massa i densitat 1,020 g cm-3.
a) Calculeu el pH d’aquesta solució. [0,5 punts]
b) S’utilitzà aquesta solució per valorar 20,0 cm-3 d’una dissolució d’àcid sulfúric
i s’arriba al punt d’equivalència amb un volum de 18,2 cm-3. Calculeu la molaritat de l’àcid sulfúric. [0,5 punts]
c) Expliqueu el procediment que seguiríeu al laboratori per dur a terme la valoracio anterior, indicant el material i l’indicador emprats. Podríeu llençar per la pica del laboratori la dissolució un cop valorada? [1 puní]
Dades: K = 39,1; H = 1,0; O = 16,0
SOLS: a) 13,64 b) 0,197M
3) pau_quim05sl
2. La pluja àcida s’origina, entre altres causes, a partir del diòxid de sofre present a l’atmosfera, que reacciona amb l’oxigen i dóna triòxid de sofre, el qual es combina posteriorment amb l’aigua de pluja i dóna àcid sulfúric.
a) Escriviu les dues reaccions esmentades. [0,5 punts]
b) Calculeu la concentració molar d’àcid sulfúric present en una mostra de 10 L d’aigua de pluja, suposant que s’ha recollit l’àcid corresponent a 15 mg de SO2. [0,5 punts]
c) Determineu el pH de l’aigua de pluja suposant que, en aquestes condicions, l’àcid sulfúric es dissocia completament. [0,5 punts]
d) Tenint en compte que, en realitat, la dissociació de l’àcid sulfúric no és completa, rao-neu si el pH veritable de la mostra d’aigua de pluja serà més gran o més petit que el calculat abans. [0,5 punts]
Dades: masses atòmiques: H = 1, O = 16, S = 32
SOLS: b) 2,34· 10-5 M c) 4,33
4) OPCIÓ A SÈRIE 1 pau_quim05jl
4. Disposem de dos recipients; un d’ells conté 25 cm3 d’àcid clorhídric 0,2 M i l’altre 25 cm3 d’àcid fluorhídric 0,2 M.
a) Justifiqueu qualitativament quina de les dues dissolucions tindrà un pH més elevat. [0,4 punts] b) Justifiqueu quina de les dues dissolucions necessitaria un volum més gran de disso-lució d’hidròxid de sodi 0,1 M per arribar al punt d’equivalència en una valoració.
[0,4 punts]
c) Indiqueu en cada cas si la dissolució resultant de la valoració un cop arribat al punt
d’equivalència és àcida, bàsica o neutra. [0,4 punts]
d) Indiqueu el significat de les advertències de perillositat que apareixen en els reci
pients d’àcid fluorhídric concentrat. [0,4 punts]

e) Raoneu quin dels dos pictogrames anteriors ha d’aparèixer als recipients d’àcid clor-hídric concentrat. [0,4 punts]
Dades: Ka (àcid fluorhídric) = 5,6 · 10–4
5) SÈRIE 1 pau_quim05jl
.1. Barregem 50 cm3 d’una solució de NaOH 0,1 M amb 100 cm3 d’una solució de NaOH 0,4 M.
.a) Trobeu la concentració de la dissolució resultant. [0,5 punts]
.b) Fem servir la dissolució que hem preparat per valorar 20 cm3 d’un àcid clorhídric de concentració desconeguda, i n’emprem 11,4 cm3 per arribar al punt d’equivalència. Determineu la concentració de la dissolució d’àcid clorhídric. [0,5 punts]
.c) Expliqueu detalladament el procediment de laboratori que cal seguir per fer la valo-ració, i esmenteu el material emprat. [1 punt]
.SOLS: a) 0,3 M b) 0,17 M
6) SÈRIE 4 pau_quim05jl
2. L’àcid nitrós és un àcid dèbil, amb una constant de dissociació Ka = 4,3 · 10–4.
a) Escriviu la reacció de neutralització de l’àcid nitrós amb l’hidròxid de bari.
[0,5 punts]
b) Calculeu la concentració que ha de tenir una dissolució d’àcid nitrós si volem que el seu pH sigui igual al d’una dissolució d’àcid clorhídric 0,01 M. [1 punt]
c) Determineu la massa d’hidròxid de bari necessària per neutralitzar 10 cm3 de la dissolució d’àcid nitrós de l’apartat b). [0,5 punts]
Dades: masses atòmiques: H = 1, N = 14, O = 16, Ba = 137,3
SOLS: b) 0,24 M c) 0,21 g
7) SÈRIE 5 pau_quim04sl
3. L’àcid fòrmic o metanoic té com a constant d’ionització Ka = 1,77 · 10–4 a 25 °C.
a) Trobeu el pH d’una dissolució 0,02 M d’àcid fòrmic. [1 punt] b) Determineu el volum de dissolució d’hidròxid de sodi 0,015 M que serà necessari per neutralitzar 30 cm3 de la dissolució de l’àcid. [0,5 punts] c) Justifiqueu si en el punt d’equivalència de la valoració el pH serà menor, igual o més gran que 7. [0,5 punts]
SOLS: a) 2,75 b) 40 cm3
8) OPCIÓ A SÈRIE 4 pau_quim04ll 2
5. L’àcid làctic (CH3CHOHCOOH) és un àcid feble monopròtic que té una gran importància en el metabolisme.
a) Determineu la seva constant d’acidesa, sabent que una dissolució 0,05 M de l’àcid té un pH de 2,6. [1 punt]
b) Barregem 25 mL de la dissolució 0,05 M de l’àcid amb 10 mL de NaOH de concen
tració 0,125 M. Justifiqueu si la dissolució resultant serà àcida, bàsica o neutra. [1 punt]
SOLS: a) 1,33 · 10-4
9) SÈRIE 4 pau_quim04ll 2
1. Per determinar la concentració d’àcid acètic (CH3COOH) en un vinagre comercial, valorem
una mostra de 10 cm3 del vinagre amb una dissolució d’hidròxid de sodi de concentració 1 M.
. a) Escriviu la reacció que té lloc entre l’àcid acètic i l’hidròxid de sodi. [0,5 punts]
.b) Si en la valoració es consumeixen 6 cm3 de la dissolució d’hidròxid de sodi, trobeu la concentració d’àcid acètic. Expresseu-la en g · dm–3. [0,5 punts]
. c) Descriviu detalladament la manera de fer aquesta valoració al laboratori i indiqueu el material que cal emprar. [1 punt]
Dades: masses atòmiques: C = 12; O = 16; H = 1
SOLS: b) 36
10) SÈRIE 1 PAU. pau_quim04jl
1. Una ampolla de dissolució d’àcid fòrmic (o metanoic) indica a l’etiqueta una concentració
de 0,015 M. Per comprovar l’exactitud d’aquesta dada, valorem una mostra de 20 cm3 d’aquesta dissolució amb hidròxid de potassi de concentració 0,01 M.
. a) Escriviu la reacció que té lloc entre l’àcid fòrmic i l’hidròxid de potassi. [0,5 punts]
.b) En la valoració es consumeixen 2 cm3 menys de dissolució d’hidròxid de potassi del que caldria esperar. Trobeu la concentració veritable de l’àcid fòrmic. [0,5 punts]
.c) Expliqueu detalladament la manera de fer aquesta valoració al laboratori i anomeneu el material emprat. [1 punt]
SOLS: b) 0,014 M
11) OPCIÓ A SÈRIE 3 pau_quim04jl
4. En la valoració d’una mostra de HCl amb una dissolució de NaOH s’ha representat gràfi
cament la concentració de protons [H+] present a cada moment en funció del volum de NaOH afegit.
.a) Justifiqueu quina de les dues gràfiques següents reprodueix millor la variació de [H+] al llarg de la valoració: [0,5 punts]
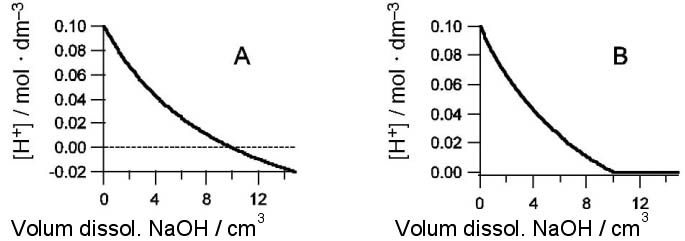
Volum dissol. NaOH / cm3 Volum dissol. NaOH / cm3
.b) Quin pH té la dissolució inicial de HCl? [0,5 punts]
.c) Quin volum de dissolució de NaOH s’ha afegit en el punt d’equivalència? [0,5 punts]
.d) Si el volum inicial d’àcid és 20 cm3, trobeu la concentració de la dissolució de NaOH. [0,5 punts]
SOLS: b) 1 c) 10 cm3 d) 0,2 M
12) OPCIÓ B SÈRIE 3 pau_quim03sl
4. El clorur d’hidrogen és un gas molt soluble en aigua i la seva dissolució aquosa s’anome-na àcid clorhídric. Es pot obtenir mitjançant reacció del clorur de sodi amb àcid sulfúric concentrat.
.a) Escriviu la reacció corresponent a l’obtenció de clorur d’hidrogen a partir dels com-postos anteriors. [0,4 punts]
.b) Trobeu el pH de la dissolució obtinguda si el clorur d’hidrogen format a partir d’1 g de clorur de sodi es dissol en 0,5 L d’aigua. [0,8 punts]
.c) Calculeu quina concentració i quin pH haurà de tenir una dissolució de NaOH tal que 1 L d’aquesta dissolució neutralitzi la dissolució d’àcid clorhídric de l’apartat anterior. [0,8 punts]
Dades: masses atòmiques: H = 1; O = 16; Na = 23; Cl = 35,5
Kw = 1.0 · 10–14
SOLS: b) 1,47 c) 0,017 M i –12,23
13) SÈRIE 5 PAU. pau_quim03jl
.3. L’àcid benzoic és un àcid monopròtic amb una constant de dissociació Ka = 6,3 · 10–5.
.a) Determineu el pH d’una dissolució 0,05 M d’àcid benzoic i la concentració de les espècies presents a la dissolució. [1 punt]
.b) Determineu el volum d’una dissolució de NaOH 0,1 M que es necessita per valorar 25 cm3 de la dissolució anterior. [0,5 punts]
.c) Justifiqueu si, en el punt d’equivalència de la valoració, la dissolució serà àcida, bàsi-ca o neutra. [0,5 punts]
SOLS: a) 2,75 b) 12,5 cm3
14) SÈRIE 2 pau_quim03jl
.2) L’àcid acetilsalicílic (aspirina), de fórmula C9H8O4, és un àcid feble i monopròtic. La seva solubilitat en aigua és de 0,5 g en 150 cm3 de dissolució, i una dissolució saturada té un pH de 2,65.
.a) Trobeu la constant d’acidesa de l’àcid acetilsalicílic. [1 punt]
.b) Justifiqueu si el pH d’una dissolució de la sal sòdica de l’àcid acetilsalicílic és menor, igual o més gran que 7. [0,5 punts]
.c) La ingestió d’aspirines pot ser perjudicial en els casos en què hi ha tendència a l’acidesa gàstrica excessiva. Justifiqueu si els següents productes serien o no adequats per compensar aquesta acidesa: [0,5 punts]
clorur de sodi vinagre
glucosa hidrogencarbonat de sodi
Dades: masses atòmiques: H = 1; C = 12; O = 16
SOLS: a) 3,1 · 10-4
15) OPCIÓ B SÈRIE 1 pau_quim02sl
4. El pH d’un producte de neteja és 11,5. Volem preparar una dissolució aquosa d’amoníac que tingui el mateix pH que el producte esmentat.
.a) Trobeu quina concentració d’amoníac haurà de tenir la dissolució. [1 punt]
.b) Per comprovar si la preparació és correcta, valorem 20 cm3 de la dissolució d’amo-
níac amb àcid clorhídric 0,50 M. Quin volum d’àcid haurem de gastar en la valoració?
[0,5 punts]
.c) Justifiqueu si el pH de la dissolució en el punt d’equivalència de la valoració serà més
petit, igual o més gran que 7. [0,5 punts]
Dades: Kb(NH3) = 1,8 · 10–5
SOLS: a) 0,558 M b) 22,3 mL
16) OPCIÓ A SÈRIE 2 pau_quim02jl
5. a) Expliqueu breument i de forma clara en què es diferencien un àcid fort i un àcid feble. [0,5 punts]
b) Expliqueu també en què consisteix el fenomen de la hidròlisi. [0,5 punts]
c) Ordeneu en ordre creixent de pH les dissolucions dels compostos següents (totes de concentració 0,1 M) i justifiqueu la resposta: [0,5 punts]
HCl, H2SO4, NaOH, NH3, CH3COOH
d) Ordeneu també en ordre creixent de pH les dissolucions següents (totes de concentració 0,1M):
NaCl, NH4Cl, KNO3, NaCH3COO [0,5 punts]
17) SÈRIE 3 pau_quim02jl
3. a) Indiqueu quin és el pH d’una dissolució 0,01 M d’àcid nítric. [0,5 punts]
.b) Afegim 0,82 g d’acetat de sodi a 1 L de la dissolució anterior. Raoneu si el pH serà petit, igual o més gran que en el cas anterior. [0,5 punts]
c) Per al cas b, calculeu la concentració d’ió acetat en la dissolució. [1 punt]
Dades: masses atòmiques: H = 1; C = 12; O = 16; Na = 23
Ka (àcid acètic) = 1,8 · 10–5
SOLS: a) 2 c) 4,2 · 10-4 M
18) SÈRIE 3 pau_quim02jl
1. Es valora una mostra de 3,0 g de sosa càustica (formada per hidròxid de sodi i impureses inerts) emprant com a agent valorant una dissolució d’àcid sulfúric 2,0 M. El punt final de la valoració s’assoleix quan s’han consumit 13,2 cm3 d’àcid.
.a) Escriviu la reacció de neutralització que té lloc en la valoració. [0,5 punts]
.b) Calculeu el percentatge d’hidròxid de sodi present en la sosa càustica. [0,5 punts]
.c) Descriviu el procediment de laboratori corresponent a aquesta valoració i indiqueu i
anomeneu els estris necessaris. [1 punt]
Dades: masses atòmiques: H = 1; O = 16; Na = 23; S = 32
SOLS: b) 70,4 %
19) OPCIÓ B SÈRIE 2 02-S2.doc
.4. A 100 cm3 d’una dissolució d’àcid nítric de concentració 0,01 M s’hi afegeix 100 cm3 d’una
dissolució d’hidròxid de bari de concentració 0,01 M.
.a) Escriviu la reacció que té lloc entre aquests dos compostos. [0,5 punts]
.b) Determineu si la reacció serà completa o hi haurà algun reactiu en excés. [0,5 punts]
.c) Calculeu el pH de les dues dissolucions inicials i el de la dissolució final. [1 punt]
Dades: Kw = 1,0 · 10–14.
SOLS: b) excés de 5 · 10-4 mol de Ba(OH)2 c) 12,3 i 11,7