TEORIA ATñMICA
(pgina 60 del llibre de text POSITRî 3)
 .1) QESTIî:
LÕaire s matria? Justifica la teva resposta.
.1) QESTIî:
LÕaire s matria? Justifica la teva resposta.
.2) a) Com pensaven que estava constituda la matria els filsofs grecs Leucip i Demcrit?
b) Fa quants anys que van viure aquests filsofs grecs?
[ ] fa 1000 anys [ ] fa 1500 anys [ ] fa 2000 anys [ ] fa 2500 anys
c) La paraula grega tomos vol dir ÒindivisibleÓ. Amb el que saps podries dir si efectivament els toms sn particules indivisibles?
.3) a) Com pensava Dalton que eren els toms?
b) Quants anys fa que va viure Dalton?
c) Sabia Dalton que els toms tenen electrons i neutrons?
.4) Element: Substncia que no pot sser descomposta en unes altres de ms senzilles perqu est formada per un nic tipus dÕtoms.
LÕor s un element. Cap qumic al seu laboratori podria descomposar un anell dÕor pur en altres substncies diferents. s un element.
Tots elements coneguts estan recollits a la Taula peridica.
En lÕactualitat (mar 2009) la Taula peridica cont 118 elements

Compost: Substncia que es pot descomposar en unes altres de ms senzilles perqu est formada per toms de ms dÕun tipus dÕelement.
LÕaigua H2O s un compost. Est formada per toms dÕhidrogen i oxigen. Al laboratori es pot fer passar un corrent elctric per una quantitat dÕaigua i aquesta es descomposa en hidrogen i oxigen. DÕaix seÕn diu lÕelectrolisi de lÕaigua
.a) Cita cinc substncies que puguis trobar a casa teva o a lÕnstitut que estiguin formades per elements. Intenta que hi hagi slides, lquides i gasoses
.b) Cita sis substncies que puguis trobar a casa teva o a lÕinstitut que estiguin formades per compostos. Intenta que hi hagi 2 slides, 2 lquides i 2 gasoses
.c) Quina s la diferncia fonamental entre un element i un compost?
.d) De les segentes substancies digues quines es poden descomposar i quines no.
En cas que es puguin descomposar indica en quines substncies
Ferro (Fe) [ ] no es pot descomposar en unes altres subtncies ms senzilles
[ ] es pot descomposar en: ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Sal de cuina (NaCl) [ ] no es pot descomposar en unes altres subtncies ms senzilles
[ ] es pot descomposar en: ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Amonac (NH3) [ ] no es pot descomposar en unes altres subtncies ms senzilles
[ ] es pot descomposar en: ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Oxigen (O2) [ ] no es pot descomposar en unes altres subtncies ms senzilles
[ ] es pot descomposar en: ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Oz (O3) [ ] no es pot descomposar en unes altres subtncies ms senzilles
[ ] es pot descomposar en: ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Nitrogen (N2) [ ] no es pot descomposar en unes altres subtncies ms senzilles
[ ] es pot descomposar en: ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
But (C4H10) [ ] no es pot descomposar en unes altres subtncies ms senzilles
[ ] es pot descomposar en: ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
.5) LÕaire s una mescla de gasos (oxigen, nitrogen i altres). Si lÕaire es pot separar en els altres gasos que el formen per qu no diem que lÕaire s un compost?
(en la pag. 40 del llibre de text POSITRî 3 tens pistes per trobar la resposta)
.6) Indica si les segents substncies sn: a) element b) compost c) mescla
MODELS ATñMICS
(pgina 62 i 63 del llibre de text POSITRî 3)
.7) Dalton, Thomson i Rutherford van anar millorant el model que descriu lÕtom. De les segents afirmacion digues quines corresponen a Dalton, a Thomson i a Rutherford
.- a) Els protons i neutrons estan situats al nucli de lÕtom ÉÉÉÉÉÉÉÉÉÉÉÉ
.- b) Els electrons giren al voltant del nucli en un espai anomenat ESCORA ÉÉÉÉÉÉÉÉÉ
.- c) LÕtom t protons, neutrons i electrons ÉÉÉÉÉÉÉÉÉ
.- d). LÕtom s indivisible i no t estructura interna ÉÉÉÉÉÉÉÉÉ
.- e) El nucli es una part molt petita de lÕtom ÉÉÉÉÉÉÉÉÉ
Com una moneda dÕun euro en comparaci dÕun estadi de futbol ÉÉÉÉÉÉÉÉÉ
.- f) LÕtom s com un pudding (bescuit) de panses on les panses sn els electrons de crrega negativa i la massa s la crrega positiva ÉÉÉÉÉÉÉÉÉ
.8) Ordena les afirmacions ( de la a a la f) de lÕanterior exercici a sota del nom del cientfic que les va dir. Escriu-les de nou, sisplau.
Dalton
Thomson
Rutherford
.9) LÕtom s molt petit 63 milions dÕtoms posats en filera farien aproximadament 1 cm de llargada.
Quants toms cabrien aproximadament en 1 mm de llargada?
.10) a) Qu vol dir que lÕtom s elctricament neutre?
b) Per qu els toms han de tenir el mateix nombre de protons que de electrons?
c) LÕatom de carboni-12 t 6 protons, 6 neutrons i 6 electrons.
LÕatom de carboni-14 t 6 protons, 8 neutrons i 6 electrons.
Digues quines afirmacions sn vertaderes
.a) [ ] LÕatom de carboni-12 i lÕatom de carboni-14 sn elctricament neutres
.b) [ ] LÕatom de carboni-12 t ms massa que lÕatom de carboni-14
.c) [ ] LÕatom de carboni-12 t crrega positiva i lÕatom de carboni-14 t crrega negativa
.11) a) Marca amb una X
Crrega positiva Crrega negativa Sense crrega
Prot [ ] [ ] [ ]
Electr [ ] [ ] [ ]
Neutr [ ] [ ] [ ]
T massa T una massa negligible ( o sigui, quasi zero)
Prot [ ] [ ]
Electr [ ] [ ]
Neutr [ ] [ ]
Dins de lÕtom es troba a:
Nucli Escora
Prot [ ] [ ]
Electr [ ] [ ]
Neutr [ ] [ ]
b) Ordena de menys a ms massa: tom, electr, prot i neutr
.12) Dibuixa un tom segons el model de Rutherford. Fes un dibuix bonic.
¥ Pinta 5 protons de color verd amb un signe +
¥ Pinta 5 electrons de color groc amb un signe -
¥ Pinta 4 neutrons de color blau
¥ Com que la massa del electro s negligible davant la massa del prot o neutr fes les boles de lÕelectr ms petites que les dels protons o neutrons
¥ Indica la part de lÕescora amb un color rosa clar
¥ Assenyala el nucli
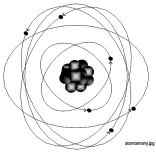 .13) Freqentement
es veu lÕtom representat de la forma que teniu a la figura del costat. Llegiu
el text que hi ha a la pg. 63 (a la foto 4) del llibre de text i expliqueu
quins aspectes dÕaquesta representaci de lÕesquerra no coincideixen amb
lÕestructura real de lÕtom
.13) Freqentement
es veu lÕtom representat de la forma que teniu a la figura del costat. Llegiu
el text que hi ha a la pg. 63 (a la foto 4) del llibre de text i expliqueu
quins aspectes dÕaquesta representaci de lÕesquerra no coincideixen amb
lÕestructura real de lÕtom
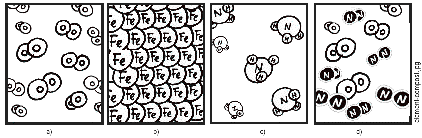
.14) Quan els toms sÕuneixen formen MOLéCULES. Per exemple dos toms dÕoxigen sÕuneixen per donar una molcula dÕoxigen O2 . LÕaigua H2O s una molcula. Fins i tot lÕADN s una molcula.
Encercla en vermell les molcules que vegis a continuaci i en blau els toms.
SUBSTËNCIES PURES I MESCLES
(pgina 40 del llibre de text POSITRî 3)
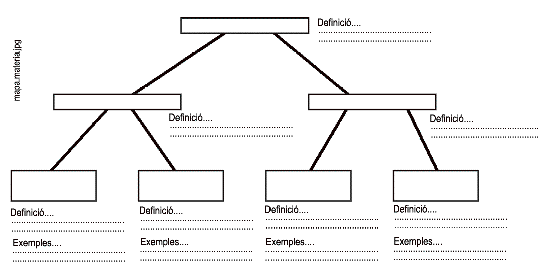
.15) a) Fes un mapa conceptual on apareguin els conceptes:
¥ materia
¥ substncies pures
¥ mescles
¥ elements
¥ compostos
¥ mescles homognies
¥ mescles heterognies
Escriu un breu definici de cada concepte a sota i els exemples quan ho demani:
.b) Classifica les segents substncies: NOTA: BRONZE: Aliatge de coure i estany
Coure [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Aigua de mar [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Aigua [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Granit [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Oxigen [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Suc de taronja [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Gasolina [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Dixid de carboni [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Carboni [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Nitrogen [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Acer [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Ferro [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Bronze [ ] element [ ] compost [ ] mescla homognia [ ] mescla heterognia
Sang [
] element [ ] compost [ ]
mescla homognia [ ]
mescla heterognia
ELS ELEMENTS A LA TAULA PERIñDICA
(pgina 80 i 81 del llibre de text POSITRî 3)
.16a) Els elements a la taula peridica sÕordenen per ordre creixent de nombre atmic.
.a) Qu s el nombre atmic dÕun tom?
.b) Qu vol dir que el carboni t nombre atmic 6?
.c) Quin s el nombre atmic del sodi?
.d) Com sÕanomena el grup dels elements que tenen nombre atmic 9,7,35, 53 i 85?
.16b)a) Numera de lÕ1 al 18 els grups de la taula peridica
b) Numera de lÕ1 al 7 els perodes de la taula peridica
c) Observa els elements anomenats Terres rares. En la pgina 81 del llibre de text POSITRî 3 trobars els seus noms. LlegeixteÕls i escriu els noms que et sonin familiars, els que hagis sentit ms dÕuna vegada.
d) Per qu es posen separats i a sota?
.7) A lÕanterior taula peridica:
¥ pinta de blau els elements metlálics ¥ posa un ratlla negra als elements slids
¥ pinta de taronja els elements no metlálics ¥ posa un ratlla grisa als elements lquids
¥ pinta de verd els semimetalls ¥ posa un ratlla lila als elements gasosos
.17)
 a) Pinta de vermell els elements del
grup 2
a) Pinta de vermell els elements del
grup 2
b) Pinta de blau els elements del tercer perode
c) Pinta de groc els elements del grup dels alcalins
d) Pinta de rosa els elements del grup dels halogens
Mira a la taula peridica de la pgina 81 del llibre de text POSITRî 3
e) Quin s lÕelement que est al segon perode, grup 16? Posa el nom i el smbol ÉÉÉÉÉÉÉ..
f) Quin s lÕelement que est al sis perode, grup 11? Posa el nom i el smbol ÉÉÉÉÉÉÉ..
h) Escriu el nom i el smbol dels elements del grup dels gasos nobles
ÉÉÉÉÉ..ÉÉÉÉÉ..ÉÉÉÉÉ..ÉÉÉÉÉ..ÉÉÉÉÉ..ÉÉÉÉÉ..ÉÉÉÉÉ..ÉÉÉÉÉ..
.18) Segur que coneixes que el Ferro (Fe), el coure (Cu) o lÕOr (Au) sn metalls per digues si els segents elements sn metalls o no metalls:
Calci. [ ] metall [ ] no metall Heli [ ] metall [ ] no metall
Bari [ ] metall [ ] no metall Tungst [ ] metall [ ] no metall
Sodi [ ] metall [ ] no metall Carboni [ ] metall [ ] no metall
Iode [ ] metall [ ] no metall Hidrogen [ ] metall [ ] no metall
Oxigen [ ] metall [ ] no metall Magnesi [ ] metall [ ] no metall
Titani [ ] metall [ ] no metall Fluor [ ] metall [ ] no metall
.19) Digues si els segents elements sn slids, lquids o gasos en condicions ambient
Oxigen [ ] slid [ ] lquid [ ] gas
Ferro [ ] slid [ ] lquid [ ] gas
Nitrogen [ ] slid [ ] lquid [ ] gas
Heli [ ] slid [ ] lquid [ ] gas
Coure [ ] slid [ ] lquid [ ] gas
Calci [ ] slid [ ] lquid [ ] gas
Mercuri [ ] slid [ ] lquid [ ] gas
.20) La taula peridica sÕanomena ÒperidicaÓ perqu es pot veure com evolucionen les propietats dels elements de forma peridica, o sigui, amb una regularitat. En cada perode es tornen a repetir les mateixes propietats
El tamany de lÕtom s una de les propietats peridiques.
a) Marca una X
¥ Al llarg dÕun perode, cap a la dreta, el tamany de lÕtom [ ] augmenta [ ] disminueix
¥ Al llarg dÕun grup, cap a baix, el tamany de lÕtom [ ] augmenta [ ] disminueix
b) Indica quin tom s ms gran:
¥ El liti [ ] o el potassi [ ]
¥ El carboni [ ] o el fluor [ ]
¥ El potassi [ ] o el calci [ ]
¥ El oxigen [ ] o el sofre [ ]
.21) Potser no hagis vist mai un tros de sodi. Pero creus que tindr brillantor metlálica, ser un bon conductor de lÕelectricitat i ser maleable? Raona-ho
.22) RECORDA: N2 , O2 , F2 , Cl2 , Br2 , I2 , N2
El elements que marquem en negre, es troben habitualment en forma diatmica, o sigui, que sn substncies formades per molcules de dos toms (diatmica).
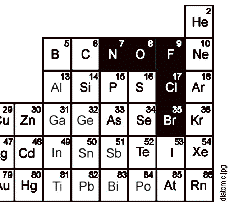
LÕhidrogen s una altra substncia molt habitual en qumica que tamb s diatmica.
Aix si en una reacci qumica interv lÕoxigen
no hem dÕescriure O (sense cap subndex),
hem dÕescriure O2 (amb el subndex 2)
I si apareix, per exemple, lÕhidrogen o el nitrogen, escriurem H2 o N2
Aquestes substncies sn totes gasoses en condicions ambient a excepci del brom Br que s un lquid vermell
Quasi tota la resta de substncies les escriurem sense cap subndex. Per exemple, lÕor, el calci, el ferro les hem dÕescriure amb el seu smbol sense subndex: Au, Ca, Fe
Hi ha algunes substncies que sÕescriuen amb el seu smbol amb subndex (amb 6, amb 8, amb 3, etc) per no es matria dÕaquest curs saber-les
Escriu el smbol de les substncies elementals segents tal com es troben en condicions ambient:
Magnesi: Mangans Potassi
Clor Heli Niquel
Alumini Nitrogen Fluor
Oxigen Mercuri Liti
ENLLA QUêMIC
(pgina 82 del llibre de text POSITRî 3)
.23) Els toms sÕuneixen uns amb altres a travs dÕenllaos
Per qu sÕuneix un tom amb un altre tom?
DÕuna forma molt resumida direm que s perqu els toms volen tenir 8 electrons en la seva ltima capa de lÕescora ja que aix els dna estabilitat.
Quan un tom t 8 electrons en la ltima capa es diu que t lÕoctet complet
Veiem un exemple:
El sodi Na t 1 electr en la seva capa ms externa i 8 electrons en la seva segona capa.
Si dna lÕelectr de la capa ms externa es quedar amb vuit electrons en la segona capa.
Aix ja tindr 8 electrons en la ltima capa i estar estable
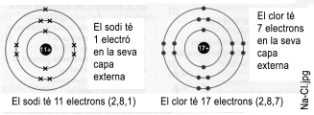
El Clor Cl t 7 electrons en la seva capa ms externa. Si agafa 1 electr i el posa a la capa ms externa, es quedar amb vuit electrons per tant ja tindr 8 electrons en la ltima capa i estar estable

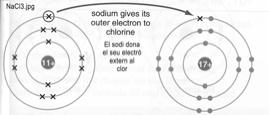
Per tant,
¥ El sodi Na vol
donar 1 electr
¥ El Clor Cl vol
agafar 1 electr
Si es troben 1 tom de Na i 1 tom de Cl, el Na li dona 1 electr al Cl i sÕuneixen mitjanant un enlla.
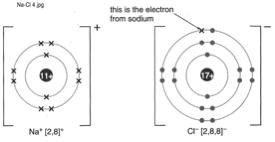 DÕaqu que la frmula del clorur de sodi sigui NaCl ( un tom de Na amb 1 tom de Cl)
DÕaqu que la frmula del clorur de sodi sigui NaCl ( un tom de Na amb 1 tom de Cl)
Un altre exemple:
El Magnesi Mg t 2 electrons en la seva capa ms externa i 8 electrons en la segona capa. Si dna els 2 electrons de la capa ms externa es quedar amb vuit electrons en la segona capa i per tant ja tindr lÕoctet complet (8 electrons en la ltima capa)
El Clor Cl ja sabem que vol agafar 1 electr
Un tom de Mg que vol donar 2 electrons necssitar 2 toms de Cl perqu li agafin els 2 electrons que vol donar
DÕaqu que la frmula del clorur de magnesi sigui MgCl2 ( un tom de Mg amb 2 toms de Cl)
Dibuixa com es forma el MgCl2 seguint els dibuixos de lÕexemple de la pgina anterior.
NOTA:
Hi ha altres formes en que els toms sÕenllacen que sÕestudiaran en altres cursos
Valncies ms freqents Valencies.doc
NOTA: Valncies, estats dÕoxidaci i nombres dÕoxidaci sn expressions equivalents
METALLS
+1 +2 +3
____________ ________________ _______________
Liti Li Beriláli Be Alumini Al
Sodi Na Magnesi Mg Bismut Bi
Potassi K Calci Ca
Rubidi Rb Estronci Sr
Cesi Cs Bari Ba +1 +2
Plata Ag Radi Ra ________________
Zinc Zn Coure Cu
I amoni NH4+ Cadmi Cd Mercuri Hg
Hidrgen H+
+1 +3 +2 +3 +2 +4
_____________ _________________ _______________
Or Au Ferro Fe Estany Sn
Niquel Ni Plom Pb
Cobalt Co Plat Pt
+2 +4 +6 +7 +3 +6
_____________ _________________
Mangans Mn Crom Cr
NO METALLS
+3 +4 - 4 +3 +5 - 3
____________ ________________ _______________
Bor B Carboni C Nitrgen N
Silici Si Fsfor P
Germani Ge Arsnic As Antimoni Sb
+2 +4 +6 - 2 +1 +3 +5 +7 - 1
________________ _______________
Oxgen O (-2) Fluor F (-1)
Sofre S Clor Cl
Seleni Se Brom Br
Teláluri Te Iode I
Formulaci dÕxids
Un xid s una combinaci dÕun element ms oxigen
NOTA: 1) l'oxigen actua amb nombre d'oxidaci -2
2) l'element pot ser qualsevol excepte el fluor, que s ms electronegatiu que l'oxigen.
Formulaci
a) Element (X) a lÕesquerra, i Oxigen (O) a la dreta X O
b) El nmero que expressa la valncia de lÕoxigen es posa com a subndex del smbol de lÕelement.
X2O
c) El nmero que expressa la valncia de lÕelement (n), es posa com a un ndex del smbol de lÕorigen.
X2On
d) Si n s mltiple de 2, es poden simplificar els valors dels subndex. Ex. S2O4 passa a SO2
X2/2On/2
EXEMPLES:
Formuleu: xid de mangans (VI)
a) Element (Mn) a lÕesquerra, i Oxigen (O) a la dreta Mn O
b) El nmero que expressa la valncia de lÕoxigen (-2) es posa com a subndex del smbol del mangans, per sense signe Mn2O
c) El nmero que expressa la valncia del mangans (VI = +6), es posa com a subndex del smbol de lÕoxigen sense el signe + Mn2O6
d) Com que 2 i 6 sn divisibles per 2 s'han de simplificar els valors dels subndex.
Mn2/2O6/2 ---> MnO3 (El subndex 1 no cal posar-lo)
Formuleu: xid de ferro (II)
a) Element (Fe) a lÕesquerra, i Oxigen (O) a la dreta Fe O
b) El nmero que expressa la valncia de lÕoxigen (-2) es posa com a subndex del smbol del ferro, per sense signe - . Fe2O
c) El nmero que expressa la valncia del ferro (II = +2), es posa com a subndex del smbol de lÕoxigen sense el signe + Fe2O2
d) Es pot simplificar si dividim els dos subndex per 2 i queda: FeO
Formuleu: xid d'alumini
Noteu que no hi ha cap nombre rom entre parntesi.
No cal perqu l'alumini noms t una valencia que s +3
a) Element (Al) a lÕesquerra, i Oxigen (O) a la dreta AlO
b) El nmero que expressa la valncia de lÕoxigen (-2) es posa com a subndex del smbol de lÕalumini, per sense signe Al2O
c) El nmero que expressa la valncia del lÕalumini (+3), es posa com a subndex del smbol de lÕoxigen sense el signe + Al2O3
d) Com que 2 i 3 no sn divisibles per 2 no es poden simplificar els valors dels subndex.
Escriu la frmula dels segents xids.
RECORDA
¥ LÕoxigen sempre actua amb valncia - 2
¥ Entre parntesis, tÕindiquem la valncia de lÕelement. Si no hi ha cap valncia vol dir que lÕelement noms en t una que haurs de buscar en la taula de valncies
¥ Has de simplificar
¥ El subndex 1 no es posa
.24) Formuleu els segents xids:
a)
.................................xid de sodi
.................................xid de rubidi
.................................xid de plata
.................................xid de nquel (II)
.................................xid de bari
b)
.................................xid de sodi
.................................xid de cadmi
.................................xid dÕalumini
.................................xid dÕestany (II)
.................................xid de plom (II)
c)
.................................xid de plat (IV)
.................................xid de coure (I)
.................................xid de mercuri (I)
.................................xid de liti
.................................xid
dÕor (I)
.25) Considera aquestes frmules moleculars:
H2SO4, C2H12O6, HNO3, CH2 (COOH) 3,
a) Quins elements constitueixen cadascun dels elements compostos?
H2SO4 ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
C2H12O6 ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
HNO3 ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
CH2 (COOH) 3 ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
b) Indica el nombre total d'toms que hi ha en cadascuna de les seves molcules.
H2SO4 toms de H ÉÉÉÉ toms de S ÉÉÉÉ toms de O ÉÉÉÉ
C2H12O6 toms de C ÉÉÉÉ toms de H ÉÉÉÉ toms de O ÉÉÉÉ
HNO3 toms de H ÉÉÉÉ toms de N ÉÉÉÉ toms de O ÉÉÉÉ
CH2 (COOH) 3, toms de C ÉÉÉÉ toms de H ÉÉÉÉ toms de O ÉÉÉÉ
.26) Fixa't en aqestes frmules que corresponen a compostos de calci:
CaS2, CaCO3, Ca(OH)2, CaSO4, Ca3(PO4)2, CaO, Ca2SiO4.
a) Ordena-les de menys a ms nombre d'toms de calci en cada substncia
b) Ordena-les de menys a ms nombre d'toms dÕoxigen en cada substncia