Reaccions químiques
.1) Un canvi és la transformació d'un sistema al llarg del temps.
a) Quan en el canvi no hi ha modificació de la matèria que composa el sistema diem que és un canvi ………………
Quan el canvi implica una modificació de la matèria diem que és un canvi……………
En el canvi ………………………… hi ha una reordenació d'àtoms mitjançant una reestructuració d'enllaços.
químico
b) En els canvis …………………………….les substàncies mantenen la seva naturalesa i les seves propietats essencials, és a dir, segueixen sent les mateixes substàncies.
En els canvis ……………………………. les substàncies inicials es transformen en altres distintes, que tenen propietats diferents
c) Un canvi químic s’nomena també r………………… q…………………….
.2) Si dobleguem o arruguem un paper, canvia d'aspecte però segueix sent paper. Diem que és un canvi …………………………… però si ho cremem, al final no queda paper: hi ha fum i cendres. És un canvi ……………………………
.3) a) Classifica les transformacions següents segons si es tracta de canvis físics o químics. Marca amb una X Físic Químic
a) Cremar un paper. [ ] [ ]
b) La dilatació del mercuri a l'interior d'un termómetre. [ ] [ ]
c) L'assecament de la pintura. [ ] [ ]
d) Fregir una hamburguesa. [ ] [ ]
e) Extreure la sal de l'aigua de mar en una salina. [ ] [ ]
f) L’oxidació del ferro. [ ] [ ]
g) La congelado de l'oli [ ] [ ]
h) La combustió de la gasolina. [ ] [ ]
i) La dissolució de sucre dins el café. [ ] [ ]
j) La cocció d'un ou ferrat. [ ] [ ]
k) L'evaporació d'un perfum. [ ] [ ]
l) La preparació d'un suc de taronja. [ ] [ ]
m) La fotosíntesi de les plantes. [ ] [ ]
n) La condensació de vapor d'aigua en un vidre. [ ] [ ]
.3) b) Raona perquè quan encenem una bombeta no es produeix cap canvi químic però si que es produeix quan encenem una espelma.
.4) Marca amb una o més X
a) La combustió de la gasolina és:
canvi químic [ ] canvi físic [ ] reacció química [ ]
b) L’oxidació de la xapa d’un cotxe és:
canvi químic [ ] canvi físic [ ] reacció química [ ]
c) La condensació del vapor d’aigua en els vidres d’un cotxe és:
canvi químic [ ] canvi físic [ ] reacció química [ ]
.5) Digues quins són els reactius i quins els productes en les següents reaccions químiques
.a) L’hidrogen i l’oxigen es combinen per donar aigua
.b) En la fotosíntesi les plantes produeixen un molècula de glucosa a partir de 6 molècules de CO2 i 6 molècules de H2O i a més desprenen O2
.c) Quan es crema butà C4H10 amb oxígen O2 es desprén diòxid de carboni CO2 i aigua H2O
.d) El diòxid de nitrogen NO2 s’obté a partir de monòxid de nitrogen NO i oxigen O2
.e) El ferro d’un clau en contacte amb l’oxigen produeix òxid de ferro
.f) L’àcid clorhídric reacciona amb l’hidròxid de sodi per donar clorur sòdic (sal comuna) més aigua
.6) L’hidrogen i l’oxigen es combinen per donar aigua. En concret dues molècules d’hidrogen es combinen amb una molècula d’oxigen per donar dues molècules d’aigua. Tal com et mostra el següent esquema
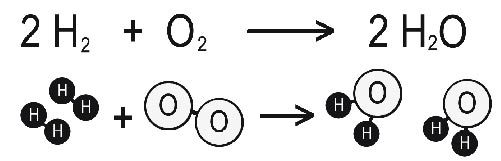
.a) Quantes molècules hi havia al començament de la reacció?
.b) Quantes molècules hi ha al final de la reacció?
.c) Quants àtoms hi havia al començament de la reacció?
.d) Quants àtoms hi ha al final de la reacció?
.e) Quins enllaços entre àtoms s’han trencat?
.f) Quins enllaços entre àtoms s’han format?
.g) Quines sustàncies han desaparegut?
.h) Quines sustàncies ha s’han format?
.i) Es conserva el nombre de molècules?
.i) Es conserva el nombre d’àtoms?
.7) Fes un esquema “de boles” com en l’exemple anterior per representar la següent reacció química:
L’òxid de calci reacciona amb l’àcid clorhídric per donal clorur de calci i aigua
CaO + 2HCl ---- > CaCl2 + H2O
Respon:
.a) Quantes molècules hi havia al començament de la reacció?
.b) Quantes molècules hi ha al final de la reacció?
.c) Quants àtoms hi havia al començament de la reacció?
.d) Quants àtoms hi ha al final de la reacció?
.e) Quins enllaços entre àtoms s’han trencat?
.f) Quins enllaços entre àtoms s’han format?
.g) Quines sustàncies han desaparegut?
.h) Quines sustàncies ha s’han format?
.i) Es conserva el nombre de molècules?
.i) Es conserva el nombre d’àtoms?
.8) a) Com anomenem les reaccions que absorbeixen energía? I les que en desprenen?
b) Cita tres exemples de la vida quotidiana on es produeixin reaccions exotèrmiques?
c) Perquè es calenta el motor d’un cotxe després de circular?
.9) Quan mesclem dues solucions transparents en un vas de precipitats, una de iodur de potassi i una altra de nitrat de plom observem que es forma en el fons del vas un precipitat de color groc el recipient augmenta la temperatura. Ha tingut lloc alguna reacció química? Raona-ho?
.10) a) El clorur de sodi o sal de cuina, NaCl, es pot descompondre en els elements sodi Na i clor Cl2, usant l'electricitat.
NaCI ---> Na + Cl2
Si descornponem 100 g de sal i obtenim 39,3 g de sodi, quants grams de clor haurem obtingut? En quina llei t’has basat?
b) Quin error hi ha en aquesta afirmació. Raona-ho:
"La descomposició de 100 g de bromur de potassi (KBr)
produeix 39 g de potassi K i 80 g de brom Br2"
.11) a) El dilluns a les 9 h del matí, deixem un clau de ferro en una taula al balcó en contacte amb l’oxigen. El ferro del clau s’oxidarà en contacte amb l’oxigen de l’aire per donar òxid de ferro, que recobreix el clau amb la típica capa rugosa marró de l’òxid. Tornem dimarts i encara el clau està brillant i sense òxid. Què ha passat? S’ha produit la reacció d’oxidació del ferro o no? Raona-ho
.12) b) Cita alguns exemples de reaccions químiques que es donin molt ràpidament, en fraccions de segon
.13) Marca la resposta correcta:
En les reaccions químiques sempre es produeix una substancia nova o mes d'una
Mai [ ] De vegades [ ] Sempre [ ]
En les es reaccions químiques s'hi produeix l'absorció o la cessió d'energia
Mai [ ] De vegades [ ] Sempre [ ]
En una reacció química la massa sempre es conserva.
Mai [ ] De vegades [ ] Sempre [ ]
.14) Marca amb una X la causa de l’augment de la velocitat de reacció en els següents processos:
a) El nitrogen i l'hidrogen es combinen entre ells per a formar amoníac mitjançant una reacció exotèrmica. Per augmentar la velocitat de la reacció el procés es fa en presencia de ferro.
[ ] S’ha augmentat la concentració dels reactius [ ] S’ha augmentat la superfície de contacte entre els reactius
[ ] S’ha augmentat la temperatura de la reacció [ ] S’ha afegit un catlitzador
b) Una foguera s’encén més ràpid amb encenalls i branques que amb trossos de fusta
[ ] S’ha augmentat la concentració dels reactius [ ] S’ha augmentat la superfície de contacte entre els reactius
[ ] S’ha augmentat la temperatura de la reacció [ ] S’ha afegit un catlitzador
c) La putrefacció dels aliments és més ràpida si els deixem sobre la taula de la cuina que si els deixem dins de la nevera
[ ] S’ha augmentat la concentració dels reactius [ ] S’ha augmentat la superfície de contacte entre els reactius
[ ] S’ha augmentat la temperatura de la reacció [ ] S’ha afegit un catlitzador
d) Si deixem caure un tros de patata dins d’una solució molt concentrada d’aigua oxigenada s’observa un bombolleig més vigorós que si la deixem caure sobre una solució diluïda d’aigua oxigenada
[ ] S’ha augmentat la concentració dels reactius [ ] S’ha augmentat la superfície de contacte entre els reactius
[ ] S’ha augmentat la temperatura de la reacció [ ] S’ha afegit un catlitzador
.15) Quines de les següents afirmacions es poden aplicar a un catalitzador
[ ] Fa que la reacció química vagi més ràpid
[ ] Fa que s’obtingui més quantitat de producte
[ ] Fa que la reacció produeixi més energia
[ ] Augmenta la velocitat de la reacció química
[ ] S’esgota un cop s’ha acabat la reacció química
[ ] És un reactiu
[ ] És un producte
.16) Quines reaccions catalitzen els catalitzadors dels tubs d’escapament del cotxes?
.17) Per què diem que els enzims són catalitzadors?
.18) Quina de les següents frases és vertadera:
[ ] a) Tots el catalitzadors són enzims
[ ] b) Tots els enzims són catalitzadors
.19) “Sintetitzar” és un terme que de vegades s’utilitza com “fabricar” tot i que no és del tot correcte. Així diem que les plantes sintetitzen matèria orgànica o també sentim que les plantes “fabriquen” matèria orgànica. De fet, fabricar és “Transformar o produir mercaderies o altres productes amb l'ajut de maquinària, d'energia, etc” Però bé, aquest utilització ens ajuda a entendre que en una reacció de síntesi “es fabrica” alguna cosa.
Mentre que en un reacció de descomposició és descompon alguna cosa
a) Classifica les següents reaccions en reacció de síntesi o reacció de descomposició
A] 2H2O2 (l) ---------> 2H2O(l) + O2 (g)
B] 2Ca(s) + O2 (g) ---------------> 2 CaO(g)
C] H2O(g) --------------> 2H2 (g) + O2 (g)
D] BaCl2 (s) -------------> Ba(s) + Cl2 (g)
E] CaO(s) + O2(g) -----------> CaCO3(c)
F] 4Fe(s) + 3O2(g) -------------> Fe2O3s)
G] 2KClO3(c) ------------> 2KCl(c) + 3O2 (g)
b) Subtratlla en cada cas quin producte s’ha sintetitzat i quin producte s’ha descompost
.19) a) Què és una reacció d’oxidació?
b) Què tenen en comú un tros de paper que es crema, la respiració d’un ésser huma i una barana d’un balcó que s’oxida?
.20) Busca i explica breument tres aplicacions per produir aliments de la fermentació?
.21) Segurament a casa teva la teva mare té bicarbonat, és un pols blanc, una substància bàsica que es pren quan algú té acidesa d’estòmac. Explica quin efecte fa el arbonat sobre l’acidesa.
.22) Escriu l’aquació química associada a les següents reaccions. No cal que l’ajustis
.a) El Ferro (Fe) reacciona amb l’oxigen (O2) per donar òxid de ferro (III) (Fe2O3)
.b) El hidròxid de sodi (NaOH) reacciona amb l’àcid sulfuric (H2 SO4) per donar clour de sòdi (NaCl) i aigua (H2O)
.c) L’òxid de mercuri(II) (HgO)) quan es calenta es descomposa en mercuri (Hg) i oxigen (O2)
.23) Descriu en paraules les següents equacions químiques
.a) H2O(g) --------------> 2H2 (g) + O2 (g)
.b) 2H2 (g) + O2 (g) --------------> H2O(g)
.c) N2 + H2 --------------> 6 NH3 (N2 = nitrogen; H2 = hidrogen; NH3= amoníac )
.24) De les equacions anteriors indica quins són els reactius i productes de cada una.
.a) Reactius:
Productes:
.b) Reactius:
Productes:
.c) Reactius:
Productes:
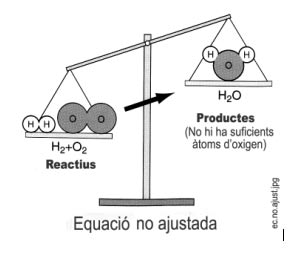
Entenem que vol dir ajustar un equació química?
Veiem un exemple: l’hidrogen i l’oxigen es combinen per donar aigua:
hidrogen més oxigen donen aigua
H2 + O2 --------> H2O
La equació escrita així no està ajustada i per tant no es compleix la Llei de conservacio de la massa, veiem-ho:
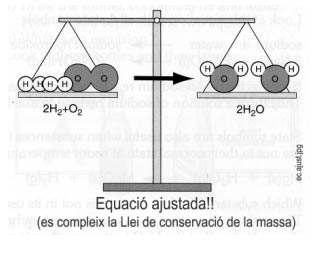
Però si posem els coeficients estequiomètrics adequats
2 H2 + O2 --------> 2 H2O
Ara sí que l’equació està ajustada i es compleix la Llei de conservacio de la massa
.25) Entre les aquacions químiques següents, digues quines estan ben ajustades i quines no
.a) FeO + CO ––> Fe + CO2 Ben ajustada [ ] Mal ajustada [ ]
.b) K2O + H2O ––> 2 KOH Ben ajustada [ ] Mal ajustada [ ]
.c) 2 KClO3 ––> KCl + O2 Ben ajustada [ ] Mal ajustada [ ]
.d) CH4 + 2 O2 ––> CO2 + 2 H2O Ben ajustada [ ] Mal ajustada [ ]
.e) H2 + O2 ––> H2O Ben ajustada [ ] Mal ajustada [ ]
.26) Completa cadascuna de les equacions químiques amb el coeficient estequiométric que hi falta:
a) 2 NO + O2 ––> [ ] NO2
b) Zn + [ ] HCI ––> ZnCl2 + H2
c) 4 HCI + O2 ––> [ ] H2O + [ ] Cl2
d) Na2S04 + 4 C ––> Na2S + [ ] CO
e) C2H4 + [ ] O2 ––> [ ] CO2 + [ ] H2O
.27) El propá, C3H8, es un combustible gasós que s'utilitza com a alternativa al gas natural. L'equació que representa la combustió d'aquest gas es:
C3H8 (g) + O2 (g) ---- > CO2 (g) + H2 O (l)
Ajusta l'equació seguint el mètode aprés.
.29) Ajusta aqüestes reaccions químiques (nivell fàcil):
a) N2 + O2 ---- > N2O3
b) C + O2 ---- > CO
c) SO2 + O2 ---- > SO3
d) Al + O2 ---- > Al2O3
e) Al + HCI ---- > AlCI3 + H2
f) C6H6 + O2 ---- > CO2 + H2O
g) Na2O + H2O ---- > NaOH
h) N2 + H2 ---- > NH3
.30) Ajusta les equacions químiques següents
a) NO (g) + O2 (g) ---- > NO2 (g)
b) Zn (s) + HCI (aq) ---- > ZnCl2 (aq) + H2 (g)
c) HCI (g) + O2 (g) ---- > H2O (I) + Cl2 (g)
d) Na2SO4 (s) + C (s) ---- > Na2S (s) + CO (g)
e) C2H4 (g) + O2 (g) ---- > CO2 (g) + H2O (l)
.31) Dibuixa amb boles que representin els àtoms la reacció de síntesi del NO2
2 NO (g) + O2 (g) ---- > 2 NO2 (g)
.a) Hi ha els mateixos àtoms al començament i al final?
.b) Hi ha les mateixes molècules al començament i al final?
.c) Raona si es conserva la massa en l’anterior reacció
El mol
.32) Completa les dues paraules que falten
El Sistema Internacional d’Unitats (SI) marca que:
• La unitat per mesurar la massa d’una substància és el quilogram que té com a símbol ……
• La unitat per mesurar el temps és el …………. que té com a símbol s
• La unitat per mesurar el quantitat de substància és el …………… que té com a símbol …….
.33) Completa les dues paraules que falten:
• Diem que dos llibres són un parell de llibres
• Diem que 12 ous són una ………………………… d’ous
• Diem que 6,02·1023 àtoms d’or són un ………………………… d’àtoms d’or
.34) Com ja saps la notació exponencial s’utilitza per facilitar l’escriptura de nombres molt grans o molt petits. Per exemple 1,05·106 és el nombre 1 050 000 (un milió cinquanta mil)
Escriu 6,02·1023 amb tots el zeros
………………………………………………………………………………………………………………………
Aquest nombre es diu: sis-cents dos mil trilions
Tot i que se li coneix amb el nom de:
Nombre d’Avogadro
El seu símbol és NA
(Un trilió és 1018, és un milió de bilions, o sigui, 1.000.000.000.000.000.000)
Un mol d’una substància són 6,02·1023 elements d’aquesta substància
Completa:
Un mol d’àtoms de ferro són ……………………………. àtoms de ferro
Un mol de molècules d’aigua són ……………………………. molècules d’aigua
Un mol de granets de sorra són ……………………………. granets de sorra
Un mol de mosques són ……………………………. mosques
Un mol d'una substància sempre pesa exactament la massa atòmica o molecular d'aquesta substància expressada en grams.
Per exemple:
La massa atòmica del Fe (ferro) és 55.847, per tant un mol d'àtoms de ferro pesa 55.847 grams.
La massa molecular de l’aigua (H2O) és 18, per tant un mol de molècules d’aigua pesa 18 grams.
La massa atòmica d’un element la podem llegir en una taula periòdica.
Teniu una a la pàgina 14 del llibre de text (POSITRÓ 3)
La massa d’un mol d’àtoms o d’un mol de molècules s’anomena massa molar
Així la massa molar del ferro és 55.847 grams per mol ( 55.847 g/mol )
I la massa molar de l’aigua (H2O) és ………………………….. g/mol
![]()
.35) Marca la resposta o les respostes correctes (pot haver més d’una):
.a) La massa molar del coure Cu és 63,5 g/mol això vol dir que:
[ ] Un mol de coure pesa 63,5 g
[ ] 63,5 mols de coure pesen 1g
[ ] 1 àtom de coure pesen 63,5 g
[ ] 6,02·1023 àtoms de coure pesen 63,5 g
.b) A la taula periòdica llegim que el carboni C té una massa atòmica de 12,01
[ ] Un mol de carboni pesa 12,01g
[ ] La massa molar del carboni és 12,01g/mol
[ ] 12,01 mols de carboni pesen 1g
[ ] 1 àtom de carboni pesen 12,01g
[ ] 12,01 àtoms de carboni pesen 1g
[ ] 6,02·1023 àtoms de carboni pesen 12,01g
.c) La fòrmula de l’aigua és H2O com ja sabeu
[ ] Una molècula d’aigua té dos molècules d’hidrogen i una molècula d’oxigen
[ ] Una molècula d’aigua té dos àtoms d’hidrogen i un àtom d’oxigen
[ ] Un mol de molècules d’aigua contenen dos mols d’àtoms d’hidrogen i un mol d’atoms d’oxigen
[ ] H2O representa un àtom d’aigua
[ ] H2O representa una molècula d’aigua
.d) La massa molar de l’aigua és 18 g/mol això vol dir que:
[ ] Un mol d’aigua pesa 18g
[ ] 18 mols d’aigua pesen 1g
[ ] 1 àtom d’aigua pesa 18g
[ ] 6,02·1023 àtoms d’aigua pesen 18g
[ ] En 18g d’aigua hi ha 6,02·1023 molècules d’aigua
[ ] En 18g d’aigua hi ha 6,02·1023 àtoms d’oxigen i 2 · 6,02·1023 àtoms d’hidrogen
[ ] En 18g d’aigua hi ha 6,02·1023 àtoms d’oxigen i 6,02·1023 àtoms d’hidrogen
.36) a) Calcula la massa d’un mol de CO2
masses atòmiques: C = 12; O = 16
b) Calcula la massa molar del CO2
masses atòmiques: C = 12; O = 16
c) Quants grams pesa una molècula de CO2 expressa el resultat en notació exponencial
.37) Busca les masses atòmiques a la taula periòdica de la pàg. 14 del llibre de text (POSITRÓ 3)
i calcula la massa molar de:
O2 oxigen Al alumini
H2 hidrogen C carboni
Al2O3 òxid d’alumini CO monòxid de carboni
NaOH hidròxid de sodi H2SO4 àcid sulfúric
CaCO3 carbonat de calci Al(OH)3 hidròxid d’alumini
.38) La reacció de combustió del metà amb oxigen és:
CH4 (g) + 2 O2 (g) ---- > CO2 (g) + 2 H2O (l)
.a) Indica quins coeficients estequiomètrics hi ha davant del CH4 , del O2 , del CO2 i del H2O
.b) Si observem l’equació química observem que 1 mol de CH4 necessita 2 mols de O2 per reaccionar.
Si nosaltres fessim la reacció partint inicialment de 5 mols de CH4 , quants mols de O2 necessitaríem?
.c) Completa:
Si inicialment partim de 3 mols de CH4 necessitaríem …………… mol de O2 . Un cop hagués reaccionat tot el CH4 i el O2 obtindríem ……… mol de CO2 i ……………. mol de H2O
Si inicialment partim de 4 mols de CH4 i 10 mol de O2 un cop hagui reaccionat tot el CH4
ens sobraran …………… mol de O2
.d) La reacció de combustió del metà és una reacció endotèrmica o exotèrmica? Per què?
.e) Escriu en paraules l’equació de combustió del metà
.38) Segons l'equació química que es mostra a continuació:
2 C2H2 (g) + 5 O2 (g) ---- > 4 CO2 (g) + 2 H2O (l)
Indica si son vertaderes o falses les afirmacions que es mostren tot seguit:
1. Per cada dos mols de C2H2 se n'obtenen dos de H2O. veritat [ ] fals [ ]
2. Calen deu mols de O2 per obtenir quatre mols de CO2 veritat [ ] fals [ ]
3. Cada molécula de C2H2 reacciona amb cinc molécules de O2 veritat [ ] fals [ ]
4. Perqué es formin setze molécules de CO2 en calen vuit de C2H2 veritat [ ] fals [ ]
5. Es formen tants mols de productes com mols de reactius desapareixen. veritat [ ] fals [ ]
.39) La reacció de síntesi de l’amoníac NH3 és
N2 + 3 H2 ---- > 2 NH3
.a) Escriu en paraules l’anterior equació
.b) Si volem obtenir 4 mols d’amoníac de quants mols de nitrogen N2 i d’hidrogen H2 hem de partir?
.c) Si tenim inicialment 12 mols d’hidrogen, quants mols de nitrogen necessitarem perquè reaccioni tot?
.d) Si partim inicialment de 4 mols de nitrogen N2 i 20 mols de hidrogen.
• Quin reactiu s’esgotarà abans? Raona-ho
• Quants mols sobraran del reactiu que està en excès?
• Quants mols de amoníac s’obtindran?
.e) La reaccio de descomposició del NaCl clorur de sodi (sal de cuina) és:
2 NaCl ---- > 2 Na + Cl2
Les masses molars són: NaCl = 58,5 g/mol; Na= 23 g/mol; Cl2= 71 g/mol
• Quina és la massa en grams de 4 mols de NaCl?
• A partir de 234 g de NaCl quants grams de Na i de Cl2 s’obtindran
Estequiometria
Estequiometria: Branca de la química que estudia les relacions numèriques segons les quals reaccionen els elements o els composts en una reacció química
.40) Donada la següent reacció:
6 PbO + O2 ----> 2 Pb3O4
Dades: 1 mol de PbO = 223,19 g; 1 mol de O2 = 32 g; 1 mol de Pb3 O4 = 685,6 g
a) RESOLUCIÓ AMB FACTORS DE CONVERSIÓ
Farem primer un exemple resolt:
Calcula la massa de Pb3 O4 que s’obtindria a partir de 1500 g de PbO.
Solució:
Massa inicial de PbO Passo els grams de PbO 2 mols de Pb3O4 Passo els mols de Pb3O4 Faig els càlculs
a grams venen de 6 mol a grams
de PbO
1500 g de PbO . 1 mol de PbO . 2 mol de Pb3 O4 . 685,6 g de Pb3 O4 = 1500 · 1· 2 · 685,6 =
223,19 g de PbO 6 mol de PbO 1 mol de Pb3 O4 223,19 · 6 · 1
= 1535,91 g de Pb3O4 s’obtindrien
b) Calcula la massa de O2 que es necessita per reaccionar amb els 1500 g de PbO.
Omple els espais que falten:
1500 g de PbO . 1 mol de PbO . . = …………… g de O2
6 mol de PbO 1 mol de O2
c) Mira l’exemple resolt 1 de la pàgina 111 del teu llibre de text POSITRO 3 Intenta fer els apartats a i b en un únic pas aplicant els factors de conversió succesivament com hem fet en els exemples anteriors.
.41) Donada la reacció de formació de l’aigua: 2 H2 + O2 ----> 2 H2O
Si partim de 10 mols d’hidrogen (H2):
a) Quants mols d’oxigen (O2) es necessiten perquè reaccioni tot l’hidrogen?
b) Quants mols d’aigua es formaran?
.42) Donada la següent reacció de combustió del propà C3H8:
C3H8 (g) + O2 (g) --> CO2 (g) + H2O (g)
a) Ajusta-la
b) Quants grams de diòxid de carboni s’obtenen a partir de 10g de propà?
c) Què volen dir les (g) que hi ha darrera de cada substància?
.43) Donada la següent reacció:
Na2CO3 (aq) + HCl (aq) --> NaCl (aq) + CO2 (g) + H2O (l)
.a) Ajusta-la.
a) Quants grams de carbonat de sodi necessitem per reaccionar amb 55 g d’àcid clorhídric?
d) Què volen dir les (aq) i (l) que hi ha darrera de cada substància?
.44) Donada la següent reacció:
KClO3 (s) --> KCl (s) + O2 (g)
a) Ajusta-la.
b) Si volem obtenir 25g de clorur de potassi KCl de quants grams de KClO3 hem de partir?
c) Quants grams d’oxigen s’obtindran?
d) Què volen dir les (s) i (g) que hi ha darrera de cada substància?
.45) L’hidròxid de sodi reacciona amb l’àcid clorhídric per donar sal comuna (clorur de sodi) i aigua.
NaOH (aq) + HCl (aq) --> NaCl (aq) + H2O (l )
a) Ajusta la reacció.
b) Si volem obtenir 5 g de clorur de sodi NaCl, quants grams de NaOH i quants grams d’HCl necessitarem?
.46) Una bombona de butà conté 12 kg de gas liquat.
La combustió del butà C4H10 amb oxígen ve donada per la següent equació:
2 C4H10 + 13 O2 --> 8 CO2 + 10 H2O
a) Quants mols d’oxigen (O2) es necessiten perquè reaccioni tot el butà contigut a l’ampolla?
b) Quants mols de CO2 es formaran un cop hagin reaccionat els 12 kg de butà continguts a l’ampolla?
c) Quants kg de H2O es formaran un cop hagin reaccionat els 12 kg de butà continguts a l’ampolla?
.47) Donada la següent reacció:
NaOH (aq) + HCl (aq) --> NaCl (aq) + H2O (l )
a) Si partim inicialment de 5 mols de NaOH i de 7,5 mols de HCl per fer la reacció, digues quin dels dos reacctius reaccionarà totalment i quin està en excés.
.48) Donada la reacció de formació de l’aigua: 2H2 + O2 ----> 2H2O.
Si partim inicialment de 100 g d’hidrogen i de 100 g d’oxigen digues :
a) Quins dels dos reactius es consumirà totalment?
b) Quants grams sobraran del reactiu que està en excès?
.
.49) La respiració consisteix en la combustió bioquímica del sucre glucosa, C6H12 O6. Aquesta reacció la podem expressar amb aquesta equació química:
C6H12 O6 + 6 O2 --> 6 CO2 + 6 H2O
Una persona crema, com a mitjana, uns 600 g de glucosa al dia. Calcula:
a) La massa d'aigua que es produirá.
b) Els mols de CO2 que es produiran.
c) La massa d'oxigen que necessitarem per completar la combustió del 600g de glucosa
SOPA DE LLETRAS Busca els 8 noms la definició dels quals es dona a sota
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
a |
M |
G |
T |
E |
S |
B |
E |
U |
K |
U |
S |
Ñ |
T |
U |
N |
|
|
b |
Q |
O |
X |
Y |
D |
N |
N |
M |
G |
B |
P |
O |
T |
A |
U |
|
|
c |
W |
Q |
L |
R |
T |
E |
D |
I |
E |
G |
T |
E |
L |
V |
C |
|
|
d |
U |
P |
I |
L |
A |
V |
O |
I |
S |
I |
E |
R |
W |
O |
A |
|
|
e |
C |
D |
D |
F |
B |
H |
T |
K |
F |
A |
G |
D |
S |
G |
T |
|
|
f |
F |
R |
A |
T |
A |
H |
E |
J |
I |
K |
L |
I |
S |
A |
A |
|
|
g |
A |
A |
D |
S |
D |
G |
R |
J |
A |
Z |
F |
J |
D |
D |
L |
|
|
h |
U |
D |
H |
M |
A |
B |
M |
A |
G |
R |
A |
G |
O |
R |
I |
|
|
i |
A |
R |
E |
A |
C |
T |
I |
U |
S |
O |
J |
L |
O |
O |
T |
|
|
j |
Q |
O |
B |
A |
B |
S |
C |
A |
V |
E |
T |
E |
N |
F |
Z |
|
|
k |
C |
E |
C |
A |
B |
A |
A |
N |
E |
M |
I |
O |
S |
T |
A |
|
|
l |
I |
E |
Z |
A |
H |
S |
Ñ |
V |
K |
L |
E |
J |
O |
E |
D |
|
|
ll |
C |
I |
C |
O |
M |
B |
U |
S |
T |
I |
O |
R |
I |
S |
O |
|
|
m |
A |
M |
I |
A |
R |
B |
E |
S |
V |
U |
L |
V |
Ñ |
I |
R |
|
|
n |
E |
D |
D |
E |
S |
C |
O |
M |
P |
O |
S |
I |
C |
I |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) Químic francès que va demostrar experimentalment la Llei de conservació de la massa
2) Reacció en que es desprèn calor
3) Substància que augmenta la velocitat de una reacció química
4) Reacció d’oxidació molt ràpida i molt exotèrmica que en molts casos desprén flama
5) Substàncies que s’escriuen a la dreta d’una equació química ( en plural)
6) Científic italià en honor del qual es va posar el nom al nombre 6,02·1023
7) 6,02·1023 àtoms de coure són un [……………] d’ àtoms de coure
8) La reacció: 2 H2O2 (l) ---------> 2 H2O(l) + O2 (g) és una reacció de .....
MOTS ENCREUATS

1 VERTICAL
Oxidació lenta i controlada que s’esdevé a l’interior de les cèl·lules dels éssers vius
HORITZONTAL
A) La velocitat de reacció s’incrementa quan s’incrementa la ………………
B) Reacció en que apareix un producte sòlid i insoluble quan es barregen dos reactius dissolts
C) Substàncies que es troben a l’esquerra en una equació química
D) Catalitzador bilògic dels éssers vius
E) Unitat de quantitat de substància en el sistema internacional
NOTES
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
NOTES
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………