Configuracions electròniques
La configuració electrònica d’un àtom es la representació de com estan distribuïts els electrons en els diferents orbitals de I’atom.
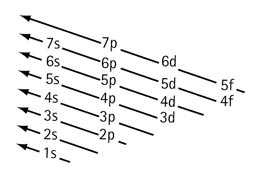 Per recordar d ‘ordre en que es van omplint els orbitals atòmics per ordre creixent d’energia, et proposem de memoritzar l’esquema de la figura. Les fletxes indiquen l’ordre en que es van omplint els orbitals d’un àtom neutre.
Per recordar d ‘ordre en que es van omplint els orbitals atòmics per ordre creixent d’energia, et proposem de memoritzar l’esquema de la figura. Les fletxes indiquen l’ordre en que es van omplint els orbitals d’un àtom neutre.
Exemples:
Carboni, C, (Z = 6): 1s2 2s2 2p2
Nitrogen, N(Z=7): 1s2 2s2 2p3
Oxigen ,(Z=8) 1s2 2s2 2p4
Fluor, F, (Z = 9): 1s2 2s2p5
Neó, Ne, (Z = 10): 1s2 2s2 2p6
Regla de l’octet
Els gasos nobles (Heli, Neó, Argó…) tenen 8 e- en la seva capa de valència, a excepció de l’heli que en té 2. És per això que s’arriba a la conclusió de que els àtoms amb 8 electrons en la capa de valència són molt estables.
REGLA DE L’OCTET:
Un àtom tendeix a guanyar, perdre o compartir electrons fins aconseguir tenir 8 electrons en la última capa (anomenada capa de valència), és a dir, l’estructura electrònica de gas noble.
ACTIVITATS
1. Escriu la configuració electrònica deis elements següents
a) argó b) clor c) zinc
d) plata e) brom f) alumini
2. A quins átoms corresponen les configuracions electróniques següents?
a) 1s2 2s2
b) 1s2 2s2 2p6 3s2 3p1
c) 1s2 2s2 2p6 3s2 3p6 4s2 3d5
3. Ordena de menor a major energia els orbitals següents:
1s, 3s, 4s. 2p, 4p, 5p, 6p, 3d, 5d, 4f
4. Escriu les configuracions electróniques dels elements de nombres atómics:
23,47,55, 72 i 92
5. Observa les configuracions electròniques següents:
O: 1s2 2s2 2p4
F: 1s2 2s2 2p5
Na:1s2 2s2 2p6 3s1
Ar:1s2 2s2 2p6 3s2 3p6
Ca:1s2 2s2 2p6 3s2 3p64s2
Raona:
a) Quins elements tenen tendència a cedir electrons. Quants e-?
b) Quins elements tenen tendència a agafar electrons. Quants e-?
c) Quins elements no volen ni cedir ni agafar electrons.