COMPOSTOS BINARIS
Estan format per dos elements.
Exemples: sal comuna formada per clor i sodi (NaCl). Hexafluorur de sofre, format per sofre i fluor (SF6)
Formulació
a) Es col·loca l’element menys electronegatiu a l’esquerra i el més electronegatiu a la dreta:
M X
Important:
M actua amb valència positiva.
X actua amb valència negativa. (Aquí s’utilitzaran les valències negatives de la llista de valències)
En general es coneix clarament quin dels dos elements és el menys electronegatiu i quin el més electronegatiu.
Recordeu:
El fluor és l’element més electronegatiu de la taula periòdica. El fluor está situat a dalt a l’esquerra.
Els no metalls són més electronegatius que els metalls
Per al casos que no estan tan clars, la següent llista ens permetrà els dubtes.
Si un element està més a la dreta és més electronegatiu
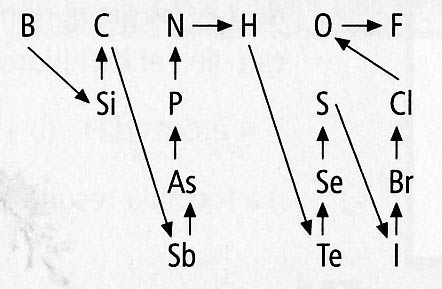
- electronegatiu > B, Si, C, Sb, As, P, N, H, Te, Se, S, I, Br, Cl, O, F > + electronegatiu
Us ajudarà recordar la disposició a la taula periòdica.
Recordeu: L’electronegativitat augmenta cap a dalt i cap a la dreta
Observeu que hem posat l’hidrogen fora del seu lloc a la taula perquè la seva electronegativitat es situi entre el N i el Te
GRUP |
13 |
14 |
15 |
|
16 |
17 |
18 |
|
|
|
|
|
H |
|
|
He |
|
|
B |
C |
N |
|
O |
F |
Ne |
|
|
Al |
Si |
P |
|
S |
Cl |
Ar |
|
|
Ga |
Ge |
As |
|
Se |
Br |
Kr |
|
|
In |
Sn |
Sb |
|
Te |
I |
Xe |
b) Un cop col·locat col·locat l’element menys electronegatiu a l’esquerra i el més electronegatiu a la dreta M X el número (sense signe) que expressa la valència de M es posa com a subíndex de X
M Xm
c) El número (sense signe) que expressa la valència de X es posa com a subíndex de M
Mx Xm
d) Si es possible, es simplifiquen els valors dels subíndex
EXEMPLES:
Formuleu: Nitrur de calci
És un compost binari format per Nitrogen (N) i calci (Ca)
a) Clarament el més electronegatiu és el nitrogen que anirà a la dreta. El calci (menys electronegatiu) a l’esquerra.
Ca N
b) El N actua amb la seva valencia negativa que és –3. Per tant hem de posar un 3 com a subíndex del Ca.
Ca3 N
c) El Ca actua amb la seva única valencia que és +2. Per tant hem de posar un 2 com a subíndex del N.
La fórmula no es pot simplificar i queda finalment
Ca3N2
Formuleu: Clorur de sodi
És un compost binari format per Clor (Cl) i Sodi (Na)
a) Clarament el més electronegatiu és el clor que anirà a la dreta. El sodi (menys electronegatiu) a l’esquerra.
Na Cl
b) El Cl actua amb la seva valencia negativa que és –1. Per tant hem de posar un 1 com a subíndex del Na. El subíndex 1, com sabem, no es posa.
c) El Na actua amb la seva única valencia que és +1. Per tant hem de posar un 1 com a subíndex del Cl. El subíndex 1, com sabem, no es posa.
La fórmula queda Na Cl
Formuleu: Flourur de sofre (VI)
És un compost binari format per Fluor (F) i Sofre (S)
a) Mirem la llista o la taula i comprovem que el F és més electronegatiu que el S. Per tant fluor a la dreta I sofre a l’esquerra.
S F
b) El F actua amb la seva valencia negativa que és –1. Per tant hem de posar un 1 com a subíndex del S. El subíndex 1, com sabem, no es posa.
c) El S actua amb la seva valencia +6 com ens indica el número romà entre parèntesis. Per tant hem de posar un 6 com a subíndex del F.
La fórmula no es pot simplificar i queda finalment
SF6
Formuleu: Hidrur de ferro (III)
És un compost binari format per Hidrogen (H) i Ferro (Fe)
d) El H és més electronegatiu que el Fe. Per tant H a la dreta i Fe a l’esquerra.
Fe H
e) El H actua amb la seva valencia negativa que és –1. Per tant hem de posar un 1 com a subíndex del Fe. El subíndex 1, com sabem, no es posa.
f) El Fe actua amb la seva valencia +3 com ens indica el número romà entre parèntesis. Per tant hem de posar un 3 com a subíndex del H.
La fórmula no es pot simplificar i queda finalment
Fe H3
Nomenclatura
a) Primer escrivim el nombre de l'element més electronegatiu (X, el de la dreta) amb la terminació -ur.
b) A continuació escrivim el nom de l'element menys electronegatiu (M, el de l’esquerra)
Si M nomes té una valència, escrivim de i el nom de l’element
EXEMPLES:
NaCI: clorur de sodi
CaF2 : fluorur de calci
NaCI: clorur de sodi
Al2S3 : sulfur d’alumini
Cd I2 : iodur de cadmi
Si l'element menys electronegatiu (M, el de l’esquerra) té diverses valències i, per tant, pot formar diverses compostos, aquests s'anomenen d'alguna de les maneres següents.
1) Nomenclatura sistemàtica
Es llegeixen els subíndexs mitjancant prefixos numerals (mono-, di-, tri-, tetra-, penta-...) que precedeixen el nom dels elements.
1 mono- (El prefix mono- només s'usa si la seva omissió pot provocar alguna ambigüitat)
2 di- 3 tri- 4 tetra-
5 penta- 6 hexa- 7 hepta-
EXEMPLES:
CuF : monofluorur de coure
Ni2Se3 : triselenur de diniquel
SF6 : hexafluorur de sofre
2) Nomenclatura Stock
S'indica el nombre d'oxidació de l'element menys electronegatiu (M, el de l’esquerra) amb xifres romanes entre parèntesis, al final de la fórmula.
EXEMPLES:
CuF : fluorur de coure (I)
Ni2Se3 : selenur de niquel (III)
SF6 : fluorur de sofre (VI)
3) Nomenclatura clàssica
a) Primer escrivim el nombre de l'element més electronegatiu (X, el de la dreta) amb la terminació -ur.
b) A continuació escrivim el nom de l'element menys electronegatiu (M, el de l’esquerra)
Atenció no escrivim de
Per especificar amb quina valencia actua l’element menys electronegatiu (M, el de l’esquerra) s'anomenará d’acord amb les terminacions:
|
|
1 valència |
2 valències |
3 valències |
4 valències |
|
hipo- -ós |
|
|
1a |
1a |
|
-ós |
|
1a |
2a |
2a |
|
-ic |
1a |
2a |
3a |
3a |
|
per- -ic |
|
|
|
4a |
EXEMPLES:
CuF : fluorur cuprós
Ni2Se3 : selenur niquèlic
NaCl: Clorur sòdic
Hidràcids
Fixeu en aquests compostos binaris: HCl, HF, H2S. Ja els hem estudiat. Observeu que l’hidrogen està a l’esquerra perquè és l’element menys electronegatiu.
Quan l’hidrogen forma compostos binaris amb.
- EIs halògens del grup 17 (F, Cl, Br i I)
- Els calcògens del grup 16 (S, Se i Te)
Formen un grup important de compostos que es caracteritzen pel fet de ser àcids en dissolució aquosa. En aquest cas diem que són hidràcids en lloc de clorurs, o sulfurs, o floururs.
S'anomenen amb la paraula àcid seguida de l'arrel de l'element acabat en -hídric.
EXEMPLES: (observeu els subíndex (g) i (aq)
El HCl(g) és un gas anomenat clorur d'hidrogen tal com ja hem estudiat.
En dissolució aquosa el HCl(aq) s’anomena àcid clorhídric
El HF(g) és un gas anomenat fluorur d'hidrogen.
En dissolució aquosa el HF(aq) s’anomena àcid fluorhídric
El H2S(g) és un gas anomenat sulfur d'hidrogen.
En dissolució aquosa el H2S (aq) s’anomena àcid sulfhídric
Altres combinacion binàries de l’hidrogen
Fixeu en aquests compostos binaris: CH4, NH3, BH3. Ja els hem estudiat. Observeu que l’hidrogen està a la dreta perquè és l’element més electronegatiu.
Quan l’hidrogen forma compostos binaris amb.
- EIs nitrogenoides del grup 15 (N, P, As i Sb)
- Els carbonoides del grup 14 (C, Si)
Formen un grup de compostos pels quals la IUPAC accepta també els seus noms comuns i que cal aprendre
|
Fórmula |
Nom comúú |
Nom sistemàtic |
|
NH3 |
Amoníac |
Trihidrur de nitrogen |
|
PH3 |
Fosfina |
Trihidrur de fòsfor |
|
AsH3 |
Arsina |
Trihidrur d'arsènic |
|
SbH3 |
Estibina |
Trihidrur d'antimoni |
|
CH4 |
Metà |
Metà |
|
SiH4 |
Silà |
Tetrahidrur de silici |
Cal destacar el NH3 (amoníac) I el CH4 (Metà) com a subtàncies molt habituals per a l’estudiant de química.
Cianurs
Son compostos formats per l'ió cianur, CN -, i un élément poc electronegatiu.
Es consideren similars als compostos que hem estudiat, com els clorurs o fluorurs i es formulen i s'anomenen de la mateixa manera.
EXEMPLES:
AgCN: cianur d'argent
Fe(CN)2: dicianur de ferro, cianur de ferro (II) o cianur ferrós
HCN (g): cianur d'hidrogen
HCN (aq): àcid cianhídric
Nota:
L’ió cianur, CN -, observeu que està format per un carboni C i un nitrogen N i té una càrrega negativa