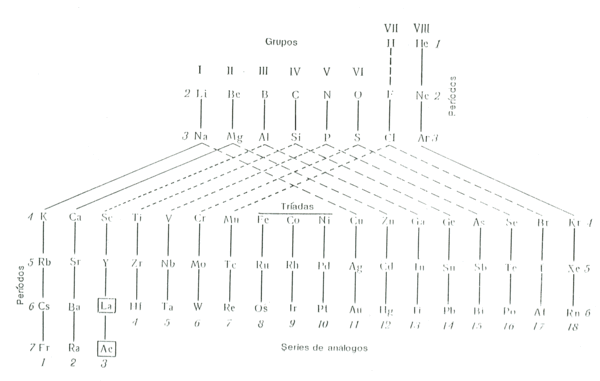
La forma de la tabla presentada por Bohr es consecuencia de la consideración de las propiedades de los elementos como sustancias simples y para las reacciones que se produzcan con intervención de dichas sustancias. Pero para el estudio de los compuestos y las reacciones que se producen entre ellos, el factor clave son las configuraciones electrónicas de los átomos en aquellos estados de valencia que les corresponden en los compuestos dados.
De lo anterior se deduce que una visión más completa de la tabla periódica sería cuando se tuvieran en cuenta las peculiaridades de los átomos tanto en su estado neutro como en todos sus estados de valencia particulares. Esta es la propuesta de Boris Nekrasov, miembro de la Academia de Ciencias de Moscu.
Nekrasov distingue tres tipos de analogías entre elementos: análogos totales que son aquellos en los que la analogía se muestra en todas sus valencias, análogos respecto a todas las valencias excepto para la valencia correspondiente al número del grupo que puede llamarse característica y análogos para la valencia característica.
De esta manera en la tabla que aquí se muestra se distinguen los elementos totalmente análogos unidos por lineas continuas, como es el caso del Na y el K.
Los que tienen analogías en todas sus valencias excepto en la característica unidos por lineas a trazos. Es el caso del Na y el Cu que en ambos casos si pierden un electrón (valencia característica) su configuración es diferente. En el primer caso es 8 (1s2, 2p6) y en el segundo 18 (3s2, 3p6, 3d10).
Por último los que presentan analogías exclusivamente en la valencia carcetrística están unidos con lineas de puntos. Es el caso del S y el Cr. Ambos elementos en su valencia +6 poseen una configuración electrónica similar en la última capa 8 (2s2, 2p6) para el S y 8 (3s2, 3p6) para el Cr.