|
Iniciación
a la bromatologia (prácticas)
|
Protocolos
de análisis
|
Ref:8.4
|
|
ALCALINIDAD
DEL AGUA
|
||
OBJETIVO Y FUNDAMENTOS
Se trata de determinar el
contenido de hidróxidos, carbonatos y bicarbonatos presentes en
el agua.
Se efectúa una valoración con disolución valorada
de un ácido mineral fuerte, referida a los puntos de equivalencia
correspondientes a los ![]() y
y
![]() (pH=8'3,
zona de viraje de la fenolftaleina) y del
(pH=8'3,
zona de viraje de la fenolftaleina) y del ![]() (pH=4'5,
zona de viraje del naranja de metileno).
(pH=4'5,
zona de viraje del naranja de metileno).
En una muestra pueden coexistir carbonatos y bicarbonatos juntos
ó hidróxidos y carbonatos juntos, pero no hidróxido
y bicarbonato.
Las reacciones en la valoración hasta el viraje de la fenolftaleína
son del tipo siguiente (el catión no tiene porqué ser necesariamente
sodio ni el ácido titulante necesariamente clorhídrico):
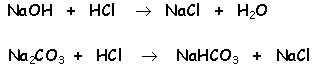
y, a partir de aquí, y hasta el viraje del anaranjado de metilo:
![]()
siendo el bicarbonato reaccionante en esta fase el que tenia originariamente la muestra más el procedente de la transformación del carbonato en la fase anterior.
MATERIAL
Bureta de 50 ml.
Matraces erlenmeyer de 250 ml.
Pipetas (el volumen depende del tipo de muestra).
REACTIVOS
Ácido clorhídrico
titulado 0'1N (o de normalidad menor).
Agua destilada.
Fenolftaleína al 0'5% en agua/alcohol 1:1.
Anaranjado de metilo al 0'05% en agua.
METODOLOGÍA
1.- Tomar 100 ml de muestra
i trasvasar a un erlenmeyer de 250 ml.
2.- Añadir dos gotas de indicador de fenolftaleína
y valorar hasta desaparición del color (rosa a incoloro). Anotar
el volumen consumido (V1).
3.- Añadir dos gotas de indicador de anaranjado de metilo
y continuar la valoración hasta virar de amarillo-naranja a rojo.
Anotar el volumen total consumido (V2). Caso de que se presenten dificultades
para apreciar el cambio de color, hervir durante unos minutos, dejar enfriar
y continuar la valoración.
4.- Efectuar un ensayo en blanco con agua destilada y restar de
los valores del problema los obtenidos en el ensayo en blanco.
CÁLCULOS
Los resultados se expresan
en miliequivalentes por litro de agua.
Si V2 = V1 (viraje inmediato
del anaranjado de metilo), la muestra únicamente contiene hidróxidos.
Si V2 = 2•V1 la muestra
únicamente contiene carbonatos.
Si V1 = 0 la muestra únicamente contiene
bicarbonatos.
Si V1 = V2 = 0 la muestra
tiene alcalinidad negativa.
Si V2 > 2•V1 la
muestra contiene carbonatos y bicarbonatos.
Si V2 < 2•V1 la muestra contiene carbonatos
y hidróxidos.
Teniendo en cuenta las consideraciones
anteriores i llamando:
VH al volumen consumido de ácido titulante
correspondiente a los hidróxidos.
VC ídem para los carbonatos.
VB ídem para los bicarbonatos.
y que estos volúmenes son nulos para aquellos componentes inexistentes, podremos calcularlos (los volúmenes) mediante las expresiones:
V1 = VC + VH
V2 - V1 = VC + VB
el contenido alcalino en miliequivalentes/litro se calcula según:
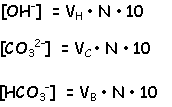
siendo N la normalidad del ácido titulante.
OBSERVACIONES
La normalidad del ácido
titulante estará en función del contenido alcalino supuesto
de la muestra.
Todos los reactivos, así como el agua utilizada en las disoluciones
y ensayos en blanco, deben ser de bajo contenido en CO2.
El CO2 de una muestra o de un agua destilada puede
eliminarse mediante reducción de presión con trompa de vacío
durante 15 minutos o por ebullición durante igual tiempo (y dejando
enfriar en un ambiente exento de CO2).
Si la alcalinidad del agua es muy alta, tomaremos una cantidad
de muestra inferior a 100 ml, (que disolveremos en agua destilada si el
volumen resultante fuera incómodo para la valoración). En
este caso, los cálculos serán:
![]()
siendo X el resultado (de carbonatos, hidróxidos. o bicarbonatos, según corresponda), V el volumen consumido, en ml, de reactivo (VH, VC ó VB, según corresponda) i v el volumen de muestra en ml.
Cuestionario 8.4.- Alcalinidad del agua
1.- ¿Porqué no pueden coexistir en la misma muestra hidróxidos fuertes y bicarbonatos?
2.- Hacer el esquema gráfico del procedimiento analítico.
3.- Deducir razonadamente las fórmulas utilizadas en los cálculos.
4.- Confeccionar el correspondiente "boletín de análisis".