

| Càrrega | Massa en repòs | |||
|---|---|---|---|---|
| 1 u (unitat de massa unificada) = 1,660540·10-27 kg | ||||
| Partícula | en C | relativa | en kg | en uma |
| electró e | -1,602177·10-19 | -1 | 9,109390·10-31 | 0,0005486 |
| protó p | 1,602177·10-19 | + 1 | 1,672623·10-27 | 1,007277 |
| neutró n | 0,0 | 0 | 1,674929·10-27 | 1,00866 |
| nucli | àtom | |
|---|---|---|
| radi, m | 10-15 | 10-10 |

Per calcular la massa atòmica d'un element s'ha de tenir en compte la massa de cada isòtop i el seu percentatge d'abundància.

Propagació en l'espai dels camps elèctrics i magnètics creats per una càrrega en moviment.

Per explicar alguns fenòmens la llum es considera formada per uns "quanta" d'energia anomenats fotons:

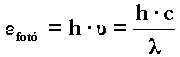

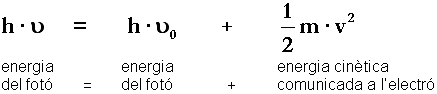

| continu | discontinu | |
|---|---|---|
| Descripció | Presenten tota la gamma d'energies de la regió escollida. No s'observen discontinuïtats entre dues longituds d'ona qualsevol. | S'observen discontinuitats entre dues longituds d'ona (falten els valors intermedis entre unes i altres). |
| Exemples |
Llum solar Llum emesa per un sòlid incandescent |
Espectres d'emisió atòmics Espectres d'absorció atòmics |

Salt de l'electró d'un nivell energètic a un altre. La transició entre dos nivells d'energia es fa per emissió o absorció d'un fotó.

Aplicació a l'àtom d'hidrogen : L'electró descriu òrbites circulars al voltant del nucli i té una energia definida i característica de l'orbita per on es mou.

Orbites el·líptiques. Introducció del nombre quàntic secundari o azimutal, l, que determina els possibles subnivells d'energia per cada valor del nombre quàntic principal, n.

Efecte d'un camp magnètic sobre el camp magnètic creat per cada electró en girar al voltant del nucli. Introducció del nombre quàntic magnètic, m.

Introducció del nombre quàntic de spin, s.

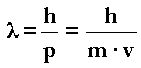
Suposa descriure l'electró com una ona Ψ.
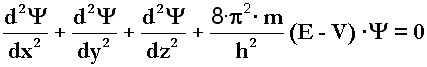
Ψ: funció d'ona (orbital). Amplitud de l'ona associada a
l'electró, m.
|Ψ|2: densitat de probabilitat relativa de l'electró.
Representa la probabilitat de trobar l'electró en un punt (x, y,
z)
E: energia total de l'electró, J.
V: energia potencial de l'electró en un punt (x, y, z). (E - V)
és el valor de l'energia cinètica de l'electró en
un punt (x, y, z).
h: constant de Planck = 6,626·10-34 J· s
m: massa reduïda de l'electró = (m1·m2)/(m1+m2)
m1: massa de l'electró
m2: massa del nucli
No es poden conèixer simultàniament i amb precisió absoluta la posició i la quantitat de moviment d'una partícula.
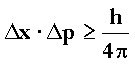

| Nom | Símbol | Valors possibles | Significat en l'orbital | Orbital |
|---|---|---|---|---|
| principal | n | 1, 2, 3, 4, ... | nivel energètic i grandària | ← |
| secundari o azimutal | l | 0, ... , (n - 1) | subnivell energètic i forma | ← |
| magnètic | m | -l, ..., 0, ..., +l | orientació a l'espai | ← |
| de spin | s | - 1/2, + 1/2 | sentit de gir de l'electró (comportament d'imant de l'electró) | |
| Orbital | ||||||
|---|---|---|---|---|---|---|
| s (l = 0) | p (l = 1) | d (l = 2) | f (l = 3) | |||
| n | l | m | s | Orbital | Nombre màxim d'electrons en el subnivell | Nombre màxim d'electrons en el nivell (2n2) |
| 1 | 0 (s) | 0 | ±1/2 | 1s | 2 | 2 |
| 2 |
0 (s) 1 (p) |
0 -1, 0, +1 |
±1/2 ±1/2 |
2s 2p |
2 6 |
8 |
| 3 |
0 (s) 1 (p) 2 (d) |
0 -1, 0, +1 -2, -1, 0, +1, +2 |
±1/2 ±1/2 ±1/2 |
3s 3p 3d |
2 6 10 |
18 |
| 4 |
0 (s) 1 (p) 2 (d) 3 (f) |
0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
±1/2 ±1/2 ±1/2 ±1/2 |
4s 4p 4d 5f |
2 6 10 14 |
32 |

Dins d'un mateix àtom no hi pot haver dos electrons amb els quatre nombres quàntics iguals.
En un subnivel parcialment ocupat, els electrons es col·loquen amb el màxim desaparellament possible.
En un àtom polielectrònic en estat fonamental, els electrons ocupen els orbitals de menys energia.

L'energia d'un orbital ve determinada pels tres nombres quàntics que el defineixen n, l i m. En absència d'un camp magnètic extern, sols depèn de n i de l.


Representació de la distribució dels electrons, en estat fonamental, en els orbitals de l'àtom.
50Sn: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2
82Pb: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5sv2 4d10 5p6 6s2 4f14 5d10 6p2