Els
hidròxids
Els hidròxids són combinacions
d'un metall amb l'ió hidròxid, OH-.
Aquests compostos també s'anomenen
bases i poden neutralitzar l'acidesa de dissolucions que continguin
un àcid ja que quan es dissolen en aigua es dissocien originant
ions hidròxid.
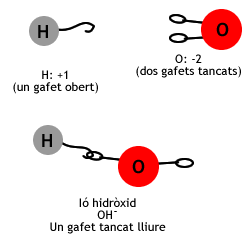
- Està format per un àtom d'hidrogen i un d'oxigen units.
- L'estat d'oxidació de l'oxigen és -2 i el de l'hidrogen +1. Per tant, la combinació resultant té una càrrega negativa: OH-.
Formulació
- METALL + OH. El metall s'escriu en primer lloc, seguit pel grup OH.
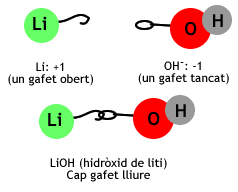
- Si el metall té estat d'oxidació +1 només s'escriu el grup OH després del símbol del metall.
- Exemple: Li(+1) + OH (-1) --- LiOH.
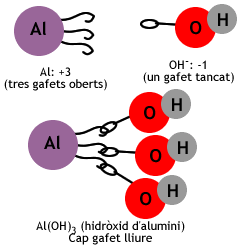
- Si el metall té un estat d'oxidació superior a +1, el grup OH s'escriu entre parèntesi amb un subíndex igual a la càrrega del metall.
- Exemple: Al (+3) + OH (-1). Si la fórmula fos AlOH, el compost quedaria amb una càrrega de +2, de manera que hem de combinar un àtom d'alumini amb tres grups OH- per tal que el compost sigui neutre: Al(OH)3.
Nomenclatura
- S'anomenen amb la paraula hidròxid seguida del nom del catió metàl·lic.
- Si el catió metàl·lic pot tenir més d'un estat d'oxidació, cal indicar-lo entre parèntesi amb xifres romanes.
- Exemple: Fe(OH)2 és l'hidròxid de ferro (II), perquè el ferro pot tenir també l'estat d'oxidació +3.
Més informació:
http://www.iesberenguer.net/departaments/fisicaiquimica/inorganica/apuntsino1.htm
![]() Material elaborat per Irene Martínez
Material elaborat per Irene Martínez
![]()

Aquesta obra està subjecta a una Llicència
de Creative Commons.