L'aigua, el dissolvent ideal
Això és el que significa dissoldre: algunes molècules d'aigua (el dissolvent) es comporten com dipols (partícules amb dos extrems, l'un amb càrrega elèctrica positiva, l'altre amb càrrega elèctrica negativa) que atreuen i envolten el ions del clorur sòdic (Na+ y Cl-), que en aquest cas és el solut.
Si
escalfem l'aigua, en augmentar la vibració de les molècules,
hi ha més molècules lliures, més dipols. Per
això és possible dissoldre més quantitat de
sòlids en aigua calenta que en aigua freda. En el cas dels
gasos, la relació és a l'inrevés: l'aigua calenta
admet menys gasos en dissolució que l'aigua freda, ja que
com més gran és la temperatura més fàcilment
escapen gasos a l'atmosfera. El poder dissolvent de l'aigua és aprofitat per tots els éssers vius per a obtenir aliment. Les plantes absorbeixen i distribueixen tots els nutrients (sals minerals) dissolts en aigua. Els animals utilitzen igualment l'aigua com a vehicle per a fer arribar l'aliment fins a totes les cèl·lules. I el plasma de la sang o la saba de les plantes no són una altra cosa que aigua amb diverses sals dissoltes. |
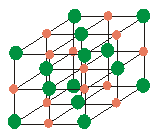 La
sal comuna (clorur sòdic) està formada per petits
cristalls cúbics i, com tot objecte, ocupa un espai. Pero
si afegim un grapat d'aquesta substància a una olla d'aigua,
veurem que la sal "desapareix". En efecte, el nivell de
l'aigua no augmenta encara per més que agreguem sal. És
evident que no la veiem ni ocupa espai addicional, però la
sal contínua estant allí. El que ha esdevingut és
que els cristalls s'ha dividit en partícules molt petites
carregades elèctricament (anomenades ions) que es
col·loquen entre els espais buits que deixen les molècules
d'aigua, atretes per aquestes.
La
sal comuna (clorur sòdic) està formada per petits
cristalls cúbics i, com tot objecte, ocupa un espai. Pero
si afegim un grapat d'aquesta substància a una olla d'aigua,
veurem que la sal "desapareix". En efecte, el nivell de
l'aigua no augmenta encara per més que agreguem sal. És
evident que no la veiem ni ocupa espai addicional, però la
sal contínua estant allí. El que ha esdevingut és
que els cristalls s'ha dividit en partícules molt petites
carregades elèctricament (anomenades ions) que es
col·loquen entre els espais buits que deixen les molècules
d'aigua, atretes per aquestes.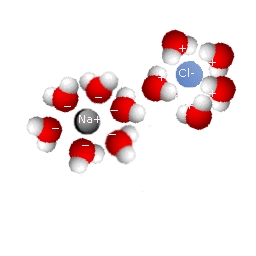 Quan
no resten més molècules d'aigua lliures, ja no cap
més sal, i tot el que tirem de més se n'anirà
al fons. La dissolució s'haurà saturat.
Quan
no resten més molècules d'aigua lliures, ja no cap
més sal, i tot el que tirem de més se n'anirà
al fons. La dissolució s'haurà saturat.