
Qüestions i Exercicis 1r de Batxillerat


Física
Cinemàtica
1.- Dos punts P i Q disten 200 m . De Q surt un mòbil i es dirigeix cap a P amb una velocitat, v = 15 m/s. Un altre mòbil surt de P 4s més tard i es dirigeix cap a Q a 20 m/s. Dibuixeu els gràfics posició-temps i dieu en quin punt i instant es creuen.
2.- Sobre els mateixos eixos de coordenades dibuixeu els gràfics posició-temps de dos mòbils, A i B, que surten de dos punts que es troben a 200 km un de l'altre. El mòbil A es dirigeix cap a B a una velocitat de 60 km/h i B es dirigeix cap a A a una velocitat de 40 km/h . Dieu en quin punt i instant es creuen.
3.- Sobre la superfície d'un llac, a 5 m sobre ella, i horitzontalment es dispara un projectil amb una velocitat de 5 m/s. Determineu:
- El temps que triga el projectil en arribar a l'aigua,
- La distància horitzontal recorreguda,
- La velocitat del projectil quan toca l'aigua.
4.- Una partícula descriu una circumferència de 3 m de radi, gira amb una velocitat angular constant de 15 voltes/minut. Calculeu l'angle descrit en 10 s, l'espai recorregut i l'acceleració centrípeta.
5.- Dos mòbils passen per un mateix punt amb mitja hora de diferència. El primer es mou amb una velocitat constant de 50 Km/h i el segon a 80 Km/h . Dieu en quin moments i a quina distància es trobaran. Resoleu el problema numèrica i gràficament..
6.- Dos projectils es llencen verticalment cap amunt des d'una altura de 30 m amb un interval de 1s; el primer amb una velocitat inicial de 50m/s i el segon amb una velocitat inicial de 80m/s. Calculeu:
- El temps transcorregut fins que es troben a la mateixa alçada.
- La altura a la qual es troben.
- La velocitat del segon projectil quan arriba a terra.
7.- Des de dos punts A i B de la mateixa vertical separats 50 m surten simultàniament dos objectes. El de més amunt cau partint del repòs i l'altre puja cap amunt amb una velocitat inicial de 30 m/s. Escriviu l'equació del moviment dels dos cossos i calculeu l'instant i el lloc de trobada.
8.- Es xuta una pilota amb una velocitat de 108 km/h i una inclinació de 60º amb l'horitzontal. Si es considera negligible la fricció amb l'aire, calculeu:
- La velocitat al punt més alt;
- L'altura màxima assolida;
- El temps que triga a tornar a terra;
- L'abast.
9.- Escriu les equacions del moviment de dos mòbils que es mouen per la mateixa recta amb velocitats de 20 i 30 m/s. El més lent surt del punt x = 150 m , i, el més ràpid surt de l'origen de coordenades. On es trobaran i quan?
10.- El conductor d'un cotxe frena uniformement i l'atura en 4 s recorrent 40 m . Calculeu la velocitat inicial i l'acceleració.
11.- L'abast d'una pedra llançada des d'un cert punt és de 82,6 m i l'altura màxima és de 11,9 m . Calculeu la magnitud i direcció de la velocitat de llançament.
Dinàmica
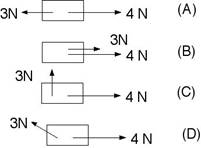
1.- Calculeu la força total aplicada als següents cossos:
2.- S'arrossega un cos de 10 kg de massa per un pla horitzontal amb una força de 100 N. El coeficient de fricció amb el terra val 0,2. Calculeu l'acceleració en els casos següents:
- La força és horitzontal.
- La força forma un angle de 30º amb l'horitzontal.
En el cas a) calculeu el treball de cada força en un desplaçament de 20 m i la velocitat final si inicialment va a 2 m/s.
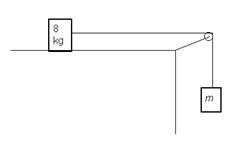
3.- Un cos de 8 kg està sobre un pla horitzontal . Si el coeficient de fregament entre el cos i la superfície horitzontal és 0,2 i aquest cos s'uneix a un altre cos de massa m mitjançant un fil a través de una politja, tal com indica la figura.
- Calculeu el valor de la massa, m, sabent que baixa amb una acceleració de 1 m/s 2 .
- Quina força, F, s'ha d'aplicar al cos de 8 kg per tal que l'altre cos pugi amb una acceleració de 0,5 m/s 2 ?.
4.- El cos de la figura té una massa de 2 kg .
- Calculeu el valor de F g .
- Quina força, F T , s'haurà d'aplicar perquè pugi amb una acceleració de 2 m/s 2 ?
![]()
5 .- En la figura següent, digueu amb quina acceleració i cap a on es mouran els cossos.

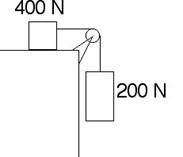
6.- Suposant nul el fregament, calculeu l'acceleració amb la qual baixarà el cos de 200 N.
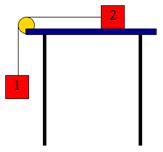
7.- El cos 1 i el cos 2 tenen la mateixa massa. Suposant nul el fregament, calculeu amb quina acceleració es mouran els cossos.
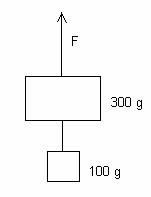
8.- Un cos de 300 g de massa penja d'un fil. Altre cos de 100 g està penjat de l'anterior mitjançant un segon fil (veieu la figura). Si s'exerceix una força cap a dalt de 6N sobre el primer fil. Calculeu amb quina acceleració es mou el sistema i la tensió del segon fil.
Treball i Energia. Potència
1.- Una bala de 10 g de massa travessa un bloc massís i la seva velocitat passa de 100 m/s a 50 m/s.
- Quanta energia cinètica perd la bala?
- Quina força fa el bloc a la bala si té un gruix de 2,5 m ?
2.- Des de quina altura s'ha llençat verticalment cap avall amb una velocitat inicial de 15 m/s una pedra de massa m si arriba a terra amb una velocitat de 40 m/s? Es suposa que l'aire no oposa resistència.
3.- Es llença un cos de 100 g de massa a 5 m/s sobre un tros de fang, si s'incrusta 2 cm . Calculeu quina força ha fet el fang sobre el cos.
4.- Es llença un cos de 1500 g cap amunt amb una velocitat inicial de 20 m/s. Si el cos puja fins a una altura de 18 m . Calculeu l'energia perduda.
5.- Des de la part més baixa d'un pla inclinat 30º es llença cap amunt un cos de 100 g . Si es considera nul el fregament del cos amb el pla, calculeu l'altura màxima que assolirà.
6.- Des d'una altura de 30 m sobre el terra es llença cap amunt un cos de 30 g de massa.
- Calculeu la energia potencial, cinètica i mecànica inicial.
- Calculeu fins a quina altura arribarà.
- Calculeu la energia potencial, cinètica i mecànica quan arriba al punt més alt.
- Calculeu la energia potencial, cinètica i mecànica quan arriba a terra.
- La velocitat amb la qual arriba a terra.
7.- La potència d'una estufa elèctrica és de 2000 w. Si funciona durant 2 hores diàries durant 1 mes, calculeu quan haurem de pagar si el preu d'un kWh és de 0,15 e .
8.- Una bomba de 500 W s'utilitza per pujar aigua d'un pou que té 40 m de profunditat. Si cada hora es treuen 2500 L d'aigua, calculeu el rendiment de la bomba.
9.- Es llença cap amunt un cos de 200 g amb una velocitat inicial de 30 m/s. Si arriba fins a una altura de 42 m , calculeu el percentatge d'energia que s'ha perduda.
Ones
1.- L'índex de refracció del vidre és 1,5. Si un raig de llum incideix sobre la superfície del vidre amb un angle d'incidència de 30º, quin serà l'angle de refracció? Quin és el màxim valor que pot tenir l'angle d'incidència per tal que un raig passi del vidre a l'aire?
2.- Un raig de llum passa de l'aigua a l'aire. Si l'índex de refracció de l'aigua respecte a l'aire és de 4/3. Quin és el màxim valor que pot tenir l'angle d'incidència per tal que el raig pugui sortir de l'aigua?
3.- Al llarg d'una corda de 2 m de longitud, fixa pels dos extrems, es propaga una onda de f =25 Hz i es formen ones estacionaries. S'observa que es produeixen 5 nodes (dos són els extrems de la corda). Calculeu la velocitat de propagació de l'ona al llarg de la corda.
4.- En una corda es propaga una ona de f=40 Hz i v=5 m/s. Si es formen ones estacionaries. Quina és la distància entre dos nodes consecutius?
5.- Dos focus puntuals, situats a 20 cm un de l'altre en la superfície de l'aigua, produeixen ones circulars de la mateixa amplitud, freqüència i longitud d'ona. La velocitat de propagació d'aquestes ones és de 60 cm/s i la f=20 Hz. Què passarà a l'interferir les dues ones en un punt situat a 20 cm d'un focus i 12,5 cm de l'altre? ¿I en un punt situat a 30 cm d'un focus i 24 cm de l'altre?
6.-
- Expliqueu els fenòmens de la refracció i la reflexió i doneu les seves lleis. Poseu exemples.
- Una ona, de longitud d'ona 1 m , passa per un forat de 20 cm de diàmetre. Es difractarà? Expliqueu perquè
7.- Expliqueu la diferència que hi ha entre una ona longitudinal i una ona transversal. Poseu un exemple de cadascuna.
8.- Què són els harmònics?
9.- Quina condició s'ha de complir per a què hi hagi difracció? I polarització?
10.- Definiu els següents termes:
- Període.
- Freqüència.
- Ona.
11.- El sonar de un vaixell registra l'eco de la seva ona 0,95 segons després d'haver emetre el so. Calculeu la profunditat de l'oceà en aquell punt. La velocitat del so a l'aigua és de 1450 m/s.
12.- Es tenen dos focus emissors de so de 100 Hz.
- Calculeu el període i la longitud d'ona.
- Dieu si es produirà una interferència constructiva en un punt situat a 100 m d'un focus i a 103,4 m de l'altre focus.
13.- Calculeu la longitud d'ona i la freqüència dels sons que emet un tub obert i un altre tancat de 1 m de longitud, si es produeix el so (harmònic) fonamental. Es suposa que la velocitat del so a l'aire és de 340 m/s.
14.- Una corda de metall fixa pels dos extrems està sotmesa a una tensió de 88,2 N. La seva longitud és de 50 cm i la seva massa de 0,50 g .
- Calculeu la velocitat de les ones transversals en la corda.
- Determineu la longitud d'ona i la freqüència fonamental, la del primer sobretò (segon harmònic) i la del segon sobretò (tercer harmònic)
15.- Els límits superior i inferior dels sons audibles per l'oïda humà són 20 Hz i 20000 Hz. Calculeu la longitud d'ona d'aquests sons.
16.- Calculeu la longitud d'ona del so emès per un diapasó de 440 Hz (és la nota utilitzada per sintonitzar orquestres) a l'aire i a l'aigua. La velocitat del so a l'aigua és 1,44 km/s.
17.- Es pot sentir el que passa a l'altra banda d'una cantonada però no es pot veure sense guaitar-hi. Per què?
Electricitat
1.- Cap a on es mou una càrrega negativa en deixar-la en repòs en un punt on el camp elèctric apunta cap al sud? Raoneu la resposta.
2.- A prop de la superfície terrestre hi ha un camp elèctric vertical i cap avall de 100 N/C. Calculeu la càrrega que s'hauria de donar a una moneda de massa 3 g per a que la força elèctrica equilibrés el pes. La càrrega, hauria de ser positiva o negativa?
3.- Una càrrega de 2 µ C està situada al punt (0,1). Una altra càrrega de -1C està situada al punt (2,0). Si les distàncies estan en metres, calculeu la força sobre una càrrega de 3 µ C situada a l'origen de coordenades.
4.- Una càrrega de 8 nC està situada a l'origen de coordenades i una altra de 12 nC està al punt (4,0). Si les distàncies estan expressades en metres,
- Calculeu la intensitat de camp al punt (6,0).
- Hi haurà algun punt de l'eix x on el camp sigui zero?
5.- Una càrrega de -4 µ C està situada al punt (4,0). Una altra càrrega de +3 µ C està situada al punt (4,4).
- Calculeu el potencial en els punts A(0,4) i B(0,0).
- Quin treball s'haurà de fer per portar una càrrega de 1 µ C des de B fins a A.
Nota: les distàncies estan expressades en metres.
6.- Un fil de ferro de 4m de longitud i 0,1 mm 2 de secció que es troba enrotllat helicoidalment es connecta a una font d'alimentació de 40 v, per la qual circula un corrent de 10 A . Calculeu la resistivitat del ferro.
7.- Se associa una resistència de 5 O en sèrie amb dues resistències de 20 O i 10 O que estan associades entre elles en paral·lel. Si el conjunt es connecta als extrems d'una pila, calculeu el voltatge de la pila sabent que per la resistència de 20 O circula una intensitat de 1 A .
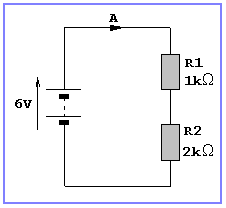
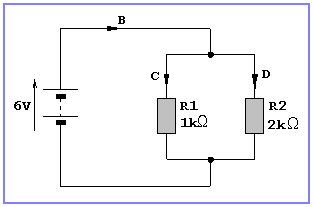
8.- Determineu les intensitats que passen per cada resistència dels circuits següents:
9.-
- Quina és la resistència equivalent a una resistència de 10 O associada en sèrie amb un conjunt de tres resistències de 2, 3 i 4 O associades en paral·lel?
- Si per la resistència de 2 O circula una intensitat d 2 A , calculeu la intensitat que circula per la resta de les resistències i el voltatge total que s'ha aplicat al conjunt de les quatre resistències.
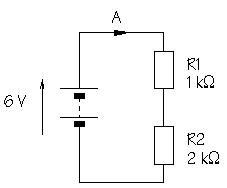
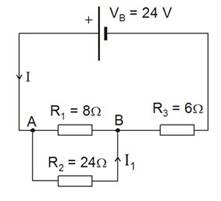
10.- Calculeu la intensitat que passa per cada una de les resistències dels circuits següents:
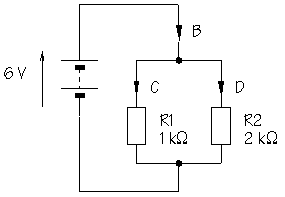
11.- Si als extrems del conjunt de resistències li apliquem una diferència de potencial de 24V, calculeu la resistència equivalent a les dues en paral·lel, la intensitat total i la de cada resistència.
http://dieumsnh.qfb.umich.mx/ELECTRO/problemas_ley_ohm.htm (en aquesta pàgina trobareu alguns problemes de circuits)
12.- Un motor elèctric de 12 CV treballa durant 10 hores. Quan costa l'energia elèctrica utilitzada si el preu de 1 kWh és de 0,16 e?
13.- Calculeu la capacitat equivalent de tres condensadors, de capacitats C1 , C2 i C3 ,
- Quan es troben en sèrie.
- Quan es troben en paral·lel.
14.- Es tenen quatre condensadors, les capacitats dels quals són de 10, 8, 6 y 4 µF respectivament. S'associa el primer en sèrie amb la resta, els quals estan connectats entre sí en paral·lel i s'aplica als extrems del conjunt una diferència de potencial de 800 volts. Calculeu:
- La capacitat equivalent.
- La càrrega que adquireix el condensador de 10 µF.
Química
Estructura de la matèria. El mol
1.- Quines partícules componen els nuclis següents? 12 C , 35 Cl, 75 As, 207 Pb i 238 U.
2.- Quants electrons i protons hi ha en els ions següents? H + , O 2- , Al 3+ , S 2- , K + i I - .
3.- Quina és la massa atòmica relativa de l'alumini ( 27Al) si un àtom d'alumini és 2,24 vegades més pesat que un àtom de 12C?
4.- El clor combinat amb l'hidrogen forma el clorur d'hidrogen: 7,1 g de clor reaccionen amb 0,2 g d'hidrogen. La fórmula del compost és HCl; quina serà la massa atòmica del clor si utilitzem com a patró l'hidrogen.
5.- El clorur de sodi, NaCl, conté un 39,3% de sodi. Quin serà el percentatge de clor en el compost? Quina serà la massa atòmica del sodi si la massa atòmica del clor és 35,5?
6.- La massa atòmica relativa de l'element bor és 10,811. El bor té dos isòtops: el B-10, de massa 10,012; i el B-11, de massa 11,009. Quin és el percentatge de cada isòtop?
7.- Quina és la massa molecular:
- Del triòxid de sofre?
- De l'àcid nítric (HNO3) ?
- De la glucosa (C6H12O6 )?
8.- Calcula la composició centesimal:
- de l'aigua,
- de l'àcid sulfúric,
- de la glucosa (C6H12O6 )
9.- Quina quantitat de substància hi ha:
- En 360 g d'aigua, expressada en mols de molècules?
- En 1,6 g d'oxigen, expressada en mols d'àtoms?
- En 8 g d'oxigen, expressada en mols de molècules?
- En 350 g de CaCO3 , expressada en mols?
10.-
- Escriu les configuracions electròniques dels elements de nombres atòmics: 35 i 56.
- En quin grup i en quin període de la taula periòdica es troba cada un?
- Indica, raonant-ho, quin dels dos elements té major potencial de ionització.
11.- On hi ha més molècules:
- En 1 mol de molècules d'aigua o en ½ mol de molècules d'hidrogen?
- En 180 g d'aigua o en 100 g d'hidrogen?
12.- La fórmula molecular de la vitamina C és C6H8O6 . Tenim 1 g de vitamina C i volem saber:
- Els mols que tenim;
- El nombre de molècules que hi ha;
- Els mols d'àtoms d'oxigen que hi ha;
- El nombre d'àtoms d'hidrogen que hi ha.
13.-
- Defineix energia d'ionització.
- Dels parells d'àtoms següents, indiqueu raonadament quin té major energia d'ionització:
-
- liti i cesi,
-
- magnesi i estronci,
-
- potassi i calci.
14.- En aquestes reaccions nuclears, podries determinar quins nuclis o partícules subatòmiques falten en els espais buits? (e: electró, n: neutró).
- ___ + 1H ? 3He
- 3He + 3He ? 4He + 2 ___
- 4He + 14N ? ___ + 1H
- 1n + 235U ? 144Ba + ___ + 3 1n
15.- Sabent que la reacció d'oxidació del ferro es pot escriure:
4Fe (s) + 3O2(g) ? 2Fe2O3(s) .
- Calcula la proporció entre els pesos de cada substància que hi intervé.
- Si deixem rovellar del tot 3,65 g de ferro, quant pesarà l'òxid que en resultarà? Quant pesa l'oxigen que hi ha reaccionat?
Gasos. Fórmules empíriques i moleculars
1.- Una quantitat de gas ocupa a 300 K un volum de 20, 3 L . Quin volum ocuparà a 400 K si mantenim la pressió constant?
2.- Quin volum ocuparia 1 m 3 d'aire a 18ºC , mesurat a una pressió d'una atmosfera, si el sotmetéssim a una pressió de 0,5 atm?
3.- Un gas a 295 K i 1 atm ocupa un volum de 2,8 L ; quin volum ocuparà si l'escalfem fins a 325 K i el comprimim a 1,5 atm?
4.- Tenim 10 g de gas amoníac (NH3 ) en un recipient en condicions normals. Quin és el volum d'aquest gas?
5.- 0,3 mol de N2 estan tancats en un recipient de 2,8 L de capacitat, a la temperatura de 20ºC . Quina en deu ser la pressió?
6.- Si introduïm 0,3 mol de Cl2 i 0,4 mol de Ne en un recipient a 18ºC , quina serà la pressió parcial de cada gas, sabent que la pressió total és de 2,1 atm?
7.- Si en un recipient de 8,2 L a 15ºC de temperatura tenim una mescla ideal de 7 g de N2 i 4 g d'O2 , quina serà la pressió total? I quina la pressió parcial de cada component?
8.- Una mescla de 17,604 g de CO2 , 4,813 g de metà i 5,602 g de CO, exerceix una pressió de 800 mm de Hg. Calculeu la pressió parcial de cada component.
Sol.: CO2 : 355 mm ; CH4 : 267 mm ; CO: 178 mm
9.- Una ampolla d'un litre de capacitat conté 200 cm 3 d'aigua líquida. Està ben tapada des de fa hores, a la temperatura ambiental de 20ºC . Quin pes d'aigua creus que es troba en forma de vapor?. La Pressió de vapor d'aigua a 20ºC és de 17,5 mm de Hg.
10.- Quan s'escalfen 0,500 g de ferro polvoritzat en corrent de clor gasós, s'obtenen 1,452 g de clorur de ferro. Calculeu la fórmula empírica de la sal.
Sol.: FeCl3
11.- Quan es cremen 8 g d'un hidrocarbur en presència d'oxigen, s'obtenen 22 g de CO2 i 18 g d'aigua. Calculeu la fórmula empírica de l'hidrocarbur.
Sol.: CH4
12.- Calcula la fórmula empírica d'un compost la composició centesimal del qual és: 27,3% de carboni; 72,7% d'oxigen.
13.- Una mostra d'un compost conté 0,99 g de carboni; 0,165 g d'hidrogen i 0,293 g de clor. Quina és la fórmula empírica d'aquest compost?
14.- Una mostra d'un compost conté 1,65 g de nitrogen i 3,78 g de sofre. La seva massa molecular relativa és 184. Quina és la fórmula molecular?
Mescles i Dissolucions
1.- Hem barrejat 2 g de clorur de sodi (NaCl) amb 48 g d'aigua. Quin és el percentatge en massa de solut?
Sol. : 4%
2.- Determina el percentatge en massa de solut d'una solució obtinguda en barrejar 4,8 g de nitrat de potassi (KNO3) i 80 mL d'aigua. Recorda que la densitat de l'aigua es pot considerar 1 g/cm 3 .
Sol. : 5,66%
3.- Hem preparat una dissolució de iode en alcohol barrejant 100 mg de iode i 200 mL d'etanol. Quin és el percentatge en massa de solut d'aquesta dissolució? La densitat de l'etanol és 0,79 g/cm3 .
Sol. : 0,06%
4.- Calcula la quantitat de solut i la quantitat de dissolvent que necessitem per preparar 500 g d'una dissolució de clorur de potassi en aigua del 3% en massa de solut.
Sol. : 15 g de solut i 485 g d'aigua
5.- Volem preparar 200 g d'una dissolució de iode en alcohol del 1% en massa de solut. Quants g de iode necessitarem? Quin volum de dissolvent emprarem? La densitat de l'etanol és 790 kg/m3 .
Sol. : 2 g de I2 i 250,6 cm3 d'etanol
6.- Volem preparar 200 g d'una dissolució aquosa que contingui un 5% de clorur de sodi (NaCl) i un 10% de clorur de potassi (KCl). Quina quantitat de cada component ens farà falta?
Sol. : 10 g de NaCl, 20 g de KCl i 170 g de H2O
7.- Calcula el volum de diclorometà necessari per preparar 200 g d'una dissolució de iode en aquest dissolvent, del 2% en massa. El diclorometà és un líquid de densitat igual a 1,32 g/cm 3 .
Sol. : 148,5 cm3 de CH2Cl2
8.- Calcula la composició, en tant per cent en massa, de la dissolució obtinguda a partir de 200 mg d'àcid benzoic i 150 mL d'acetat d'etil. L'acetat d'etil és un líquid de densitat 0,90 g/cm3 .
Sol. : 0,15%
9.- Quants grans cadascun dels soluts següents faran falta per preparar 200 g d'una dissolució d'aquestes sals en aigua, d'un 5% en massa de sulfat de sodi (Na2SO4), un 2% en massa de clorur de sodi (NaCl) i un 3% en massa de clorur de potassi (KCl)? Quin volum d'aigua necessitarem?
Sol. : 10 g de Na2SO4 , 4 g de NaCl, 6 g de KCl i 180 cm3 de H2O
10.- A 145 g d'una dissolució de sulfat de coure en aigua del 10% en massa, hi hem afegit 5 g més d'aquesta sal. Calcula la concentració del solut de la nova solució.
Sol. : 13%
11.- Calcula la concentració, expressada en tant per cent en massa, de la dissolució obtinguda en barrejar 20 g d'una dissolució de clorur de sodi en aigua, del 10% en massa amb 80 g d'una altra dissolució d'aquesta mateixa sal, del 5% en massa.
Sol. : 6%
12.- Calcula el volum d'aigua expressat en dm 3 que haurem d'afegir a 400 g d'una solució de clorur de sodi en aigua del 10% en massa, per tal de diluir-la fins a una concentració del 8% en massa.
Sol. : 0,1 dm3 de H2O
13.- Calcula la concentració de la dissolució obtinguda en barrejar 100 mg de sulfat de coure(II) en aigua, fins a obtenir 250 mL de solució.
Sol. : 0,0025 mol/dm3
14.- Com prepararies 100 mL d'una dissolució de clorur de sodi en aigua de concentració 2,5 g/dm3 ?
Sol. : pesaria 0,25 g de NaCl ...
15.- Hem separat 10 mL d'una solució de clorur de potassi en aigua de 3 g/dm3 . A continuació hem introduït els 10 mL de solució en una càpsula de porcellana i hem escalfat la mescla fins que s'ha assecat. Quina quantitat de residu sòlid obtindrem?
Sol. : 0,3 g de KCl
16.- Hem barrejat 250 mL d'una solució de clorur de sodi en aigua de concentració igual a 8 g/dm3 amb 50 mL d'una altra dissolució d'aquesta mateixa sal en aigua, de 4 g/dm3 . Calcula la concentració de la mescla (suposa que els volums són additius, és a dir, que el volum de la mescla és 300 mL).
Sol. : 7,3 g/dm3
17.- Calcula la quantitat d'hidròxid de sodi, en grams, necessària per preparar 150 mL d'una solució 2 mol/dm3 d'aquesta substància en aigua.
Sol. : 0,3 mols, 12 g de NaOH
18.- Calcula la molaritat d'una solució obtinguda en barrejar 2,55 g de nitrat de potassi (KNO3) en aigua, fins a un volum de 250 mL de solució.
Sol. : 0,1 mol/dm3
19.- D'una solució 0,5 mol/dm3 de KCl en aigua, hem separat 50 mL i després hem escalfat la solució fins a aconseguir evaporar tot el dissolvent. Quina quantitat de residu sòlid obtindràs?
Sol. : 1,86 g
20.- Calcula els grams d'àcid nítric que contenen 10 mL d'una solució aquosa comercial d'aquest àcid. Les solucions comercials d'àcid nítric en aigua són del 60% i la densitat és, aproximadament, 1,38 g/cm3 .
Sol. : 8,28 g
21.- Tenim una dissolució d'àcid sulfúric de densitat 1,83 g/cm3 i del 96% en massa.
- Quina és la massa de 1 L d'aquesta solució?
- Quants grams d'àcid conté 1 L de dissolució?
- Quants mols d'àcid sulfúric hi ha en 1 L de solució?
- Quants mols d'àcid sulfúric hi ha en 100 mL de solució?
Sol. : 1830,0 g ; 1756,8 g ; 17,9 mols; 1,79 mols
22.- La densitat d'una dissolució comercial d'amoníac en aigua és 0,92 g/cm3 . Aquesta dissolució conté un 20% en massa d'amoníac. Calcula quants mols d'amoníac hi ha en 100 mL d'aquesta dissolució.
Sol. : 1,08 mols de NH3
23.- Calcula la molaritat d'una solució d'àcid acètic de densitat 1,0052 g/cm3 i del 5% en massa.
Sol. : 0,84 mol/dm3
24.- Quin volum d'una dissolució aquosa d'àcid clorhídric 10 mol/dm3 cal per preparar 250 mL de solució 0,2 mol/dm3 d'aquest àcid?
Sol. : 5 cm3
25.- Calcula la molalitat de la dissolució obtinguda en barrejar 1,8 g de glucosa, C6H12O6 , en 250 g d'aigua.
Sol. : 0,04 mol/kg
26.- Quina és la molalitat d'una solució de clorur de sodi en aigua del 5% en massa?
Sol. : 0,9 mol/kg
27.- Les frases següents no són correctes. Indica, de les quatre opcions que et proposem, la que explica millor la incorrecció:
* “Uns exemples de substàncies pures, des del punt de vista químic, poden ser l'aire pur, l'aigua pura d'un riuet i la llet pura”.
- No són mai pures perquè és inevitable que continguin una petita part d'impureses.
- Una d'aquestes és una mescla.
- Dues d'aquestes substàncies són mescles.
- Totes tres substàncies són mescles.
Enllaç químic
1.- Admetent enllaços covalents, escriu l'estructura de les espècies químiques següents, utilitzant la notació de Lewis: Cl2O, NH3, SiF4, NCl3, CH3Cl, BF3.
2.- Tenint en compte les propietats que s'indiquen, expliqueu, raonant-ho, el tipus d'enllaç a les xarxes cristal·lines de les substàncies següents:
- Substància A: És conductora de l'electricitat, tant en estat sòlid com fosa.
- Substància B: Sòlid de punt de fusió elevat. Fosa i en dissolució condueix el corrent elèctric. No el condueix en estat sòlid.
3.-
- Explica les propietats de l'enllaç iònic.
- Digues el tipus d'enllaç que hi ha en les següents substàncies i ordena-les per punt de fusió creixent: clor, cristall de clorur de sodi, tetraclorur de carboni.
4.- La configuració electrònica d'un element X en estat fonamental és: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2 .
- Indica a quin grup i període del SP pertany.
- Quin tipus de sòlid forma quan reacciona amb oxigen?
- Quines propietats tindrà aquest sòlid en quant a temperatura de fusió i conductivitat elèctrica en estat fos?
5.- Digues, raonadament, quina molècula és més polar: CH4 o NH3
6.- L'hidrogen és un gas poc soluble en aigua. En canvi, el clorur d'hidrogen és molt soluble en aigua. A què es deu aquest comportament diferent?
7.- Explica les característiques, les propietats i posa 2 exemples de compostos que presenten enllaç covalent, iònic i metàl·lic.
8.- A temperatura ambient, el clorur de sodi i el diamant són sòlids, però la naturalesa dels seus reticles cristal·lins és molt diferent. Explica quina estructura cristal·lina té cadascun d'ells i dedueix algunes propietats directament relacionades amb la seva estructura.
9.- Les frases següents no són correctes. Indica, de les quatre opcions que et proposem, la que explica millor la incorrecció:
* “Els sòlids iònics presenten una estructura formada per ions positius i negatius; per aquest motiu són conductors del corrent, ja que les seves càrregues elèctriques donen lloc al corrent.
- Són conductors perquè alguns ions poden marxar del seu lloc.
- Són conductors gràcies als electrons que salten d'un ió a l'altre.
- No són conductors perquè cap càrrega no pot marxar del seu lloc.
- No són conductors perquè són aïllants
Formulació inorgànica
1.- Formuleu:
- Ió mercuri(II)
- Ió bromur
- Ió nitrat
- Fluorur de cesi
- Heptaòxid de diclor
- Iodur d'hidrogen
- Amoníac
- Hidròxid de beril·li
- Àcid fluorhídric
- Àcid sulfurós
- Sulfur de níquel (III)
- Hidròxid de ferro (III)
- Àcid perclòric
- Àcid permangànic
- Perclorat de zinc
- Sulfat de coure (II)
- Hidrur de calci
- Òxid de calci
- Hidròxid de zinc
- Clorur d'argent
- Clorur de coure(II)
- Àcid perclòric
- Iodur d'hidrogen
- Sulfat de ferro(III)
- Hidròxid de sodi
- Diòxid de sofre
- Monòxid de carboni
- Carbonat de niquel(II)
- Sulfur d'hidrogen
- Òxid de or (I)
- Heptaòxid de diclor
- Hidrur de sodi
- Hidròxid de ferro (III)
- Àcid sulfúric
- Ió clorur
- Àcid fosfòric
- Àcid nítric
- Permanganat de potassi
- Ió carbonat
- Ió bari
- Àcid ortosilícic
- Clorur de magnesi
- Hipoiodat de cesi
- Ió alumini
- Òxid de bari
- Ió cobalt (III)
- Heptaòxid de diclor
- Hidrur de beril.li
- Hidròxid de plata
- Monòxid de diiode
- Àcid tel.lurhídric
- Ió perclorat
- Nitrat de magnesi
- Iodat de liti
- Dicromat de potassi
- Àcid fosfòric
- Hidrogencarbonat de sodi
- Àcid selènic
2.- Anomeneu:
- Cl -
- HCl
- SiH4
- CO
- Li2O
- Br2O7
- MnO2
- H2S
- HMnO4
- CrI3
- Ca(OH)2
- ZnS
- HNO3
- Na +
- HIO3
- ClO4 -
- CO2
- KOH
- KBr
- Al2(CO3)3
- HF
- H2SO4
- CuO
- AgNO3
Càlculs estequiomètrics
1.- Tenim 0,15 mol de molècules d'hidrogen i 0,10 mol de molècules d'oxigen. Les fem reaccionar. Quants mols i quantes molècules d'aigua s'han format?
Equació: H2(g) + ½ O2(g) ? H2O (l)
2.- L'àcid sulfúric ataca l'alumini; obtenim hidrogen gas i sulfat d'alumini. Si 0,80 mol d'Al es barregen amb 1,0 mol de H2SO4 , quin és el reactiu limitant? Quants mols d'hidrogen s'han produït? Quants mols del reactiu que es troba en excés quedaran al final de la reacció?
Equació: 3 H2SO4(aq) + 2 Al (s) ? Al2(SO4)3(aq) + 3 H2(g)
3.- L'element ferro es pot obtenir a partir de l'alumini i de l'òxid de ferro(III). L'equació és la següent:
2 Al (s) + Fe2O3(s) ? Al2O3(s) + 2Fe (s)
- Quina massa d'alumini es necessita per produir 1 kg de ferro?
- Quants àtoms d'alumini s'han utilitzat en el procés?
4.- Una mescla de gasos a la pressió de 10 4 Pa i a 300 K conté un 10% en massa d'acetilè (etí), un 10% en massa de metà i la resta d'oxigen. a) Calculeu la pressió parcial de l'oxigen. b) Si la mescla està continguda en un recipient de 1 dm3 i es fa saltar una guspira elèctrica, els gasos reaccionen i s'obté diòxid de carboni i aigua. Calculeu la pressió total a l'interior del recipient, si la temperatura final és de 600 K.
5.- Es té un aliatge d'alumini i magnesi, la composició de la qual es vol saber. Una mostra de 0,70 g d'aliatge es tracta amb un excés d'àcid clorhídric diluït. L'hidrogen obtingut ocupa un volum de 846,7 cm3 a 300 K i 10 5 Pa. Calculeu la composició de l'aliatge.
6.-
- Es disposa de 1 g de HCl, 1 g de H2SO4 i 1 g de H3PO4. Quin necessita major quantitat de NaOH per neutralitzar-se?
- Si es té una mostra de 2 g de NaOH impurificat amb NaCl, es dissol en aigua i es fa reaccionar amb HCl 2 mol/dm3 , es necessiten 20 mL de la solució àcida per fer la neutralització. Calculeu el percentatge de NaOH a la mostra original.
Sol.: b) 80%
7.- La pedra calcària, formada principalment per carbonat de calci, és dissol amb àcid clorhídric segons l'equació:
CaCO3(s) + 2 HCl (aq) ? CaCl2(aq) + CO2(g) + H2O (l)
Si 10,0 g de CaCO3 es barregen amb 100 ml d'una dissolució de HCl de concentració 4,00 mol/dm3 , quina massa de CO2 es formarà?
8.- El zinc reacciona amb l'àcid sulfúric per formar sulfat de zinc i hidrogen. Calcula el volum d'àcid sulfúric que es necessita del 20,1% en massa i de densitat 1,14 g/cm3 per tal que reaccioni amb 20 g de zinc.
Equació: Zn (s) + H2SO4(aq) ?ZnSO4(aq) + H2(g)
9.- L'òxid de coure(II) reacciona amb el carboni i es forma coure i diòxid de carboni. Quina massa de coure s'obté si s'han format 8,00 dm3 de CO2 en condicions normals?
Equació: 2 CuO(s) + C(s) ? 2 Cu(s) + CO2 (g)
10.- Fem reaccionar 10 g de Zn del 80% de riquesa amb àcid HCl en excés. Quants litres d'H2 es recolliran en condicions normals?
Equació: Zn (s) + H2SO4(aq) ? ZnSO4(aq) + H2(g)
11.- El sulfit de calci es pot obtenir per reacció de l'òxid de calci i del diòxid de sofre. Calcula el pes d'òxid de calci del 90% de riquesa necessari per obtenir 3 kg de sulfit de calci.
Equació: CaO (s) + SO2(g) ? CaSO3(s)
12.- L'òxid de ferro(III) reacciona amb el carboni, de la qual cosa s'obté ferro i diòxid de carboni. El rendiment del procés és del 80%. Calcula la quantitat d'òxid de ferro que es necessita per obtenir 10 g de ferro.
Equació: 2 Fe2O3(s) + 3 C (s) ? 4 Fe (s) + 3 CO2(g)
13.- En l'obtenció d'amoníac a partir de N2 i H2 es fan reaccionar 10,00 g de nitrogen amb 1,00 g d'hidrogen. Calcula el rendiment de la reacció si al final s'obtenen 2,12 g d'amoníac.
Equació: N2(g) + 3 H2(g) ? 2 NH3(g)