Qüestions i Exercicis 2n de Batxillerat


Física Cinemàti
1.- Dos pobles disten entre sí 180 km . Simultàniament surten de cada poble, i en sentits contraris, dos ciclistes amb velocitats constants de 25 km/h i 40 km/h . En quin punt de la carretera es trobaran? Quan de temps trigaran els seus moviments? Resoleu el problema gràfica y numèricament.
2.- Un cotxe, partint del repòs, es mou amb una acceleració constant de 0,3 m/s2 .
- Quina velocitat tindrà després de 1 minut d'iniciar el moviment?.
- Quina distància haurà recorregut durant el primer minut?
- Quina distància haurà recorregut fins el moment en el qual la seva velocitat és de 108 km/h ?
3.- Es llença verticalment cap amunt una pilota des del terrat d'un edifici de 10 m d'alçada amb una velocitat de 4,8 m/s. Calculeu:
- La altura màxima assolida per la pilota sobre el terra.
- El temps que triga la pilota en arribar a terra.
- La velocitat amb la qual arriba a terra.
4.- Un automòbil que va a 72 km/h frena en una recta, parant-se en 10 s. Calculeu:
- L'acceleració, suposada constant,
- L'espai recorregut fins que s'atura.
5.- Un cotxe va de A fins a B amb una velocitat de 90 km/h . En el mateix instant surt de B fins a A un altre mòbil a 72 km/h . Calculeu en quin punt es trobaran, si la distància entre A i B és de 620 km .
6.- Calculeu l'angle recorregut per un punt d'un disc, que gira a 16 rpm, en un temps de 30 s.
7.- Un mòbil partint del repòs es mou amb una acceleració constant de 5 m/s2 .
- Calculeu el temps que triga en recórrer 100 m .
- Calculeu la velocitat en el moment que hagi recorregut els 100 m .
- Representeu la gràfica velocitat-temps i espai-temps del moviment..
8.- Des de la terrassa d'un edifici de 30 m d'altura es llença horitzontalment una pedra amb una velocitat inicial de 40 m/s. Expresseu el vector de posició i el vector velocitat en funció del temps i calculeu a quina distància de l'edifici xocarà amb el terra i quina velocitat portarà en aquest instant.
9.- Una pedra es llença verticalment cap amunt amb una velocitat de 20 m/s. Quan va cap avall és atrapada en un punt situat a 5 m per sobra del lloc on va ser llençada.
- Calculeu la velocitat en el moment de ser atrapada.
- Calculeu el temps transcorregut fins que s'atura.
10.- Dos mòbils es desplacen sobre una mateixa trajectòria. Les equacions dels seus moviments per a unitats del SI són: s1 =t3 -6t2 i s2 =8-t 3 .
- Calcula la distància que els separa en l'instant en què ambdós tenen la mateixa acceleració.
- Determina si els seus moviments són accelerats o retardats en aquell instant.
11.- Les rodes d'un automòbil que circula a 81 km/h roden sense lliscar sobre el paviment (això significa que la distància recorreguda pel vehicle és igual a la longitud de l'arc girat per la perifèrica d'una roda). Calcula la velocitat angular de les rodes, si el seu radi és de 30 cm . Quantes voltes donarà una roda en 30 segons si la velocitat del cotxe es manté invariable?
12.- Un automòbil descriu una corba de 40 m de radi en una carretera que té un peralt de 30º. El coeficient de fregament estàtic per lliscament entre els pneumàtics i el paviment és de 0,3. Determina la velocitat màxima i mínima de l'automòbil per descriure aquesta corba sense lliscar lateralment.
Dinàmica
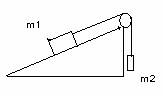
1.- En la figura següent, m1 = 2 Kg , m2 = 200 g i l'angle del pla és de 30º i el coeficient de fregament entre el pla i m1 és 0,2. Calculeu la tensió de la corda, la força de fregament, el sentit en el qual es mouen els cossos i l'acceleració amb la qual es mouen.
2.- En la figura següent, calculeu la tensió de la corda i l'acceleració amb la qual es mouen els cossos.
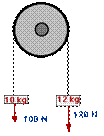
3.- Suposant nul el fregament, calculeu la tensió de la corda i l'acceleració amb la qual es mouen els cossos.
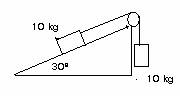
4.- En la figura següentm el coeficient de fregament entre el pla i el cos de 10 kg és 0,1.
- En quin sentit es mouran els cossos?
- Calculeu la tensió de la corda i l'acceleració amb la qual es mouen.
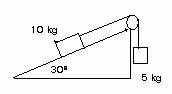
5.- El coeficient de fricció entre els blocs i el terra horitzontal és de 0,2. Calculeu l'acceleració i les tensions de les cordes si les masses d'A i de B també són de 3 kg .
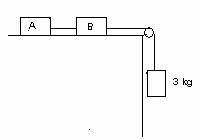
6.- Un petit cos de massa 100 g està penjat del sostre mitjançant un fil de 35 cm de longitud. S'impulsa el cos de manera que quedi girant en un pla horitzontal descrivint una circumferència amb una velocitat lineal de 84 cm/s. Suposant negligible la resistència de l'aire, calcula el radi de la circumferència que descriu i la tensió del fil.
7.- Un cos de 200 g de massa, quan es mou a 9 m/s, xoca amb un altre de 300 g de massa que es troba en repòs. A conseqüència de l'impacte, el primer cos es desvia 90º de la direcció inicial i es redueix la seva velocitat a 3 m/s. Calcula la velocitat del segon cos després del xoc i determina si aquest ha estat perfectament elàstic.
8.- Un cos de massa 2 kg es troba sobre un pla horitzontal a una distància de 50 cm de l'extrem d'una molla de constant elàstica k = 200 N/m. El coeficient de fregament cinètic per lliscamet entre el cos i el pla és 0,4. Es llança el cos, el qual llisca cap a l'extrem de la molla, amb una velocitat inicial de 6 m/s. Calcula la deformació màxima que experimentarà la molla.
Treball i Energia. Potència
1.- El consum d'aigua d'una ciutat de 50000 habitants és de 200 litres per habitant i dia. Els dipòsits són a 100 m d'altura respecte del riu. Els motors treballen 12 h al dia. Trobeu la potència útil i la nominal dels motors si el seu rendiment és del 80%.
2.- Trobeu el centre de masses d'un filferro homogeni que té forma de triangle equilàter d' 1 m de costat.
3.- Calculeu la posició del centre de masses de tres partícules de masses 3 kg , 4 kg i 2 kg situades als punts (3,0), (-3,0) i (0,4) respectivament.
4.- (S) Una bola d'acer xoca elàsticament contra un bloc de 1 kg inicialment en repòs sobre una superfície plana horitzontal. En el moment del xoc la bola té una velocitat horitzontal de 5 m/s. El coeficient de fricció dinàmic entre la superfície i el bloc és m = 0,2. Com a conseqüència del xoc, el bloc recorre 2 m abans d'aturar-se. Calculeu:
- La velocitat del bloc just després del xoc.
- La massa de la bola d'acer.
- L'energia cinètica perduda pe la bola en el xoc elàstic.
5.- (S) Una partícula descriu un moviment parabòlic en les proximitats de la superfície de la Terra. Dieu si es conserva:
- L'energia cinètica de la partícula.
- La quantitat de moviment de la partícula.
- L'energia mecànica de la partícula.
6.- (S) Un vagó de massa 1000 kg es desplaça a una velocitat constant de 5 m/s per una via horitzontal sense fricció. En un moment determinat xoca amb un altre vagó de massa 2000 kg que estava aturat, de manera que després de la col·lisió queden units. Calculeu:
- La velocitat que tindrà el conjunt després del xoc.
- L'energia mecànica perduda en el xoc.
7.- (S) Una massa m1 = 200 g es troba en repòs sobre una superfície horitzontal, sense fricció apreciable, unida a l'extrem d'una molla de massa negligible que per l'altre extrem està unida a una paret i inicialment no està ni comprimida ni estirada. Una segona massa m2 = 600 g es desplaça sobre la mateixa superfície amb una velocitat v = 4 m/s i es dirigeix en sentit a la primera massa, xocant frontalment amb ella, de manera perfectament inelàstica. La constant recuperadora de la molla val k = 500 N/m. Calculeu:
- L'energia mecànica perduda en el xoc.
- La compressió màxima de la molla.
- la velocitat del sistema quan el desplaçament, mesurat des del punt on es produeix el xoc, és de 6 cm .
8.- Sobre un pla inclinat es llança cap a dalt un cos amb una velocitat inicial de 80 m/s, quan ha recorregut 500 m la seva velocitat és de 10 m/s. Si la inclinació del pla és de 30º, calculeu l'energia perduda i el coeficient de fregament entre el cos i el pla.
9.- Dos cotxes de masses M1 = 800 kg i M2 = 600 kg es mouen en direccions perpendiculars. El primer, a velocitat horitzontal v1 = 36 km/h i el segon, a velocitat vertical v2 = 18 km/h . Els cotxes xoquen de manera totalment inelàstica.
- Quins són els components del vector quantitat de moviment total abans i després del xoc?
- Quina és la velocitat (en mòdul i direcció) del conjunt dels dos cotxes després del xoc?
- Quanta energia s'ha perdut en el xoc?
10.- Un camió de 60 tones porta una velocitat de 72 km/h quan comença a frenar. Si s'atura 10 s després, quina ha estat la potència mitjana de frenada?
Camp Gravitatori
1.- La Terra es mou al voltant del Sol seguint una òrbita aproximadament circular de radi 1,5 x 10 11 m . El seu període és un any. Calculeu la massa del Sol.
Dada: G = 6,67 x 10 -11 Nm2 /kg2 .
2.- A quina altura per damunt de la superfície terrestre el pes d'un cos es farà la quarta part del seu valor a la superfície?
Dada: RT = 6400 km
3.- El cometa Halley té un període aproximat de 75 anys. La distància de la Terra al Sol és de 1,5 x 10 11 m i el seu període un any.
- Calculeu la massa del Sol.
- Quant val la distància mitjana del cometa Halley al Sol
Dada: G = 6,67 x 10 -11 N.m2 /kg2
4.- El planeta Júpiter, perfectament visible a simple vista, posseeix quatre grans satèl.lits: Ió, Europa, Ganímedes i Cal.listo, visibles amb prismàtics. S'ha observat que Ió fa una volta al voltant del planeta en 42,5 hores. El radi mitjà de l'òrbita de Ió s'estima en 422000 km . Suposant circular aquesta òrbita, calcula la massa de Júpiter.
5.- (S) Un hipotètic planeta té la mateixa massa que la Terra i un radi doble.
- Quan val la gravetat a la superfície d'aquest planeta?
- Si traslladem al planet un rellotge de pèndol que a la Terra estavá perfectamet ajustat, s'avança o s'endarrereix? Per què?
6.- (S) La massa de Saturn és de 5,69 . 1028 kg . Un dels satèl·lits, Mimas, té una massa de 3,8 . 1019 kg i un radi de 1,96 . 108 m . Determineu:
- El període de revolució de Mimas al voltant de Saturn.
- El valor de l'acceleració de la gravetat a la superfície de Mimas.
- La velocitat d'escapament de la superfície de Mimas.
Dada: G = 6,67 x 10 -11 N.m2 /kg2
7.- (S) Si la intensitat del camp gravitatori a la superfície de la Lluna és g L , a quina altura sobre la superfície de la Lluna la intensitat del camp gravitatori val g L /5?
Dades: G = 6,67 x 10 -11 N.m2 /kg2 , ML = 7,34 . 1022 kg , RL = 1740 km
8.- (S) Tenim una massa de 10 kg en repòs sobre la superfície terrestre. Quin treball cal fer per pujar-la fins a una altura de 10 m ? I fins a una altura de 630 km ?
Dades: G = 6,67 x 10-11 N.m2 /kg2 , MT = 5,98 . 1024 kg , RL = 6370 km
9.- (S) Júpiter és l'objecte més màssic del sistema solar després del Sol. La seva òrbita al voltant del Sol es pot considerar circular, amb un període de 11, 86 anys. Determineu:
- La distància de Júpiter al Sol.
- La velocitat de Júpiter en la seva òrbita al voltant del Sol.
- L'energia mecànica total (cinètica i potencial de Júpiter)
Dades: G = 6,67 x 10 -11 N.m2 /kg2 , MJ = 1,9 . 1027 kg , MS = 2,0 . 1030 kg
10.- (S) Dos satèl·lits A i B tenen la mateixa massa i giren al voltant de la Terra en òrbites circulars, de manera que el radi de l'òrbita d'A és més gran que el radi de l'òrbita de B.
- Quin dels dos satèl·lits té més energia cinètica?
- Quin dels dos satèl·lits té més energia mecànica?
Electricitat i Magnetisme
1.- Calculeu el valor d'una càrrega puntual d'1 g de massa si en situar-la al buit a una distància d'1 cm d'una altra càrrega de 2x10- 7 C , si la força elèctrica compensa exactament el pes.
2.- Calculeu el camp elèctric que crea una càrrega de +20 nC a una distància de 5 cm . Quina força rep una càrrega de –5 mC situada al punt exterior? Digueu la direcció i sentit tant del camp elèctric com de la força calculades anteriorment.
3.- Una càrrega de 2 µC està situada al punt (6,0) i una altra càrrega de –5 µC està situada al punt (0,4). Les distàncies estan mesurades en metres.
- Calculeu el valor del camp creat al punt (0,0).
- Calculeu el valor del potencial elèctric al punt (0,0) i al punt (0,2)
- Calculeu el treball que s'haurà de fer per portar una càrrega de –3 µC des del punt (0,0) al punt (0,2)
4.- Digueu raonadament si són certes o falses les següents afirmacions:
- Un cos que freguem i carreguem positivament rep un excés de protons.
- Si el carreguem negativament rep un excés d'electrons.
- Per transportar una càrrega d'1 C necessitem uns sis trilions d'electrons.
- La força entre càrregues elèctriques només depèn del valor de les càrregues i de la distància que les separa.
- La intensitat de camp i el potencial elèctric són magnituds vectorials.
Dada: càrrega de 1 electró = 1,6 x 10- 19 C .
5.- En tres dels vèrtex d'un quadrat de 4 cm de costat estan situades sengles càrregues elèctriques puntuals de 0,5 nC cadascuna. Determina la intensitat del camp al quart vèrtex, si la permitivitat relativa del medi que les separa és d'1,2.
6.- Un electró es troba en el buit entre les armadures d'un condensador pla, que estan separades 3 cm .
- Calcula la seva acceleració quan la diferència de potencial entre ambdues armadures és de 200 V.
- Si l'electró estava en repòs en una de les armadures, quina serà la seva velocitat en arribar a l'altra?
- Quin temps emprarà l'electró per desplaçar-se d'una armadura a l'altra?
Dades: Massa de l'electró: 9,1x10- 31 kg ; càrrega de l'electró: -1,6x10- 19 C .
7.- (S) Un condensador pla té les plaques metàl·liques verticals i separades 2 mm. En el seu interior hi ha un camp elèctric constant, dirigit cap a l'esquerra, de valor 10 5 N.
- Calculeu la diferència de potencial entre les plaques del condensador. Feu un esquema del condensador i indiqueu quina placa és la positiva i quina la negativa.
- Calculeu la diferència de potencial entre dos punts A i B de l'interior del condensador separats 0,5 mm i col·locats de manera que el segment AB és perpendicular al camp elèctric. Justifiqueu la resposta.
- Considereu un electró a la regió entre les dues plaques del condensador. Si el deixem anar des del repòs molt a prop de la placa negativa, determineu amb quina energia cinètica arriba a la placa positiva. Els efectes gravitatoris es poden considerar negligibles.
Dades: Massa de l'electró: 9,1x10- 31 kg ; càrrega de l'electró: -1,6x10- 19 C .
8.- Un electró, l'energia cinètica del qual és 2x10-16 J, entra perpendicularment en un camp magnètic d'inducció 3x10-3 T. Quin és el radi de la circumferència que descriu?
Dades: Massa de l'electró: 9,1x10- 31 kg ; càrrega de l'electró: -1,6x10- 19 C .
9.- (S) Un electró es mou en un camp magnètic uniforme i descriu una trajectòria circular en el pla del paper. Determineu la direcció i el sentit del camp magnètic amb referència al pla del paper. Raoneu la resposta.
10.- (S) L'energia cinètica d'una partícula carregada, pot ser modificada per un camp magnètic uniforme? I per un camp elèctric uniforme? Justifiqueu les respostes.
Moviment Vibratori i Ones
1.- (S) Una partícula descriu un moviment vibratori harmònic horitzontal. La seva posició en funció del temps ve donada per l'equació x = 0,40 sin ( p t), en unitats del SI. Calculeu:
- La freqüència del moviment.
- L'acceleració de la partícula quan es troba a 20 cm a l'esquerra de la seva posició d'equilibri.
2.- (S) Un objecte de massa 3 kg penja d'una molla. Des de la osició d'equilibri l'estirem cap avall una distància de 25 cm i, des d'aquest punt i trobant-se inicialment en repós, el deixem oscil·lar lliurement. El període d'oscil·lació és de 1 s. Determineu:
- Les constants A, w , j , en unitats del SI, de l'equació y = A cos ( w t + j ) que descriu el moviment de l'objetcte.
- El valor màxim de l'acceleració de l'objecte, la seva direcció i sentit, i els punts de la trajectòria en què s'assoleix.
- La constant recuperadora de la molla.
3.- (S) Disposem de dues molles idèntiques, fixades al sostre. Pengem una massa A a la primera molla i una massa B a la segona, i les deixem oscil·lar amb un moviment harmònic simple.
- Si m A = 2 m B , determineu la relació entre els períodes d'oscil·lació.
- Expliqueu com afecta l'amplitud de l'oscil·lació al valor del període.
4.- (S) Calculeu el valor de la longitud d'ona d'un fotó d'energia 3 keV.
Dades: h = 6,62 . 10-34 J.s, C = 3 . 108 m/s, 1 eV = 1,602 . 10-19 J
5.- (S) Una ona elàstica ve descrita per l'equació d'ones y(x,t) = 0,1 sin 2 p (x – 10t), en unitats del SI. Determineu:
- La longitud d'ona i el període.
- La velocitat de propagació de l'ona.
4.- (S) En una cubeta d'ones es generen ones transversals planes de 10 cm d'amplitud. El generador fa 10 oscil·lacions cada 5 s. La vora de la cubeta es troba a 60 cm de distància i les ones tarden 1 s a arribar-hi. DetermineulL'equació de les ones generades en la superfície de la cubeta (en unitats del SI).
Les ones fan oscil·lar un tap de suro de 5 g que es troa a la cubeta, amb un moviment vibratori harmònic. Calculeu:
- L'energia cinètica del suro quan la seva elongació és de 5 cm .
- L'energia mecànica total del suro.
5.- L'índex de refracció del vidre és 1,5. Si un raig de llum incideix sobre la superfície del vidre amb un angle d'incidència de 30º. Calculeu el angle de refracció. Quin és el màxim valor que pot tenir l'angle d'incidència per tal que el raig passi del vidre a l'aire?
6.- Dos focus puntuals, situats a 20 cm un de l'altre en la superfície de l'aigua, emeten ones circulars d'igual amplitud, freqüència i longitud d'ona. La velocitat de propagació d'aquestes ones és de 60 cm/s i la f = 20 Hz. Què passarà si les dues ones interfereixen en un punt situat a 20 cm d'un focus i 12,5 cm de l'altre? I en un punt situat a 30 cm d'un focus i 24 cm de l'altre?
7.- Dos focus puntuals situats a 20 cm l'un de l'altre en la superfície de l'aigua emeten ones circulars d'amplitud, freqüència i fase iguals. La velocitat de propagació d'aquestes ones és de 60 cm/s i la seva freqüència de 20 Hz. Què passarà si les dues ones interfereixen en un punt situat a 20 cm d'un focus i a 12,5 cm de l'altre? I en un punt situat a 30 cm d'un focus i 24 cm de l'altre
8.- L'equació d'una ona harmònica és, en unitats del SI: y=0,3sin( p t/3 - p x/6). Quant valen l'amplitud i el període del moviment? I la velocitat d'un punt situat a 0,5 m de l'origen i a l'instant t=1s?
9.- (S) Fent servir un diapasó es genera una ona sonora unidimensional de 440 Hz de freqüència i 10 mm d'amplitud, que viatja en direcció radial des del focus emisor. La velocitat de propagació de so en l'aire, en les condicions de l'experiment, és de 330 m/s. Determineu:
- L'equació del moviment de l'ona generada (en unitats del SI).
- El desfasament en la vibració de dos punts separats 1,875 m en un mateix instant.
- La màxima velocitat de vibració (en unitats del SI) d'una molècula d'oxigen de l'aire que fa de transmissor de l'ona, que es troba a 1 m del diapasó.
10.- (S) Un mirall esfèric concau té un radi de curvatura R. Dibuixeu els diagrames de raigs necessaris per localitzar la imatge d'un objecte petit en forma de fletxa situat sobre l'eix del mirall, a una distància d de l'extrem del mirall, en els casos següents:
- d = 2R
- d = R/3
(S): Problemes trets de les proves de Selectivitat
Química
Estructura atòmica
1.- Per als elements de nombres atòmics 19, 20, 3 y 35:
- Escriu les seves configuracions electròniques
- Defineix energia de ionització i compara la dels elements 3 i 19.
- Defineix electroafinitat i compara la dels elements 20 i 35
- Compara el radi atòmic dels elements 3 i 19.
2.-
a) Defineix energia d'ionització.
b) Dels parells d'àtoms següents, indiqueu raonadament quin té major energia d'ionització:
- liti i cesi,
- magnesi i estronci,
- potassi i calci.
3.- La configuració electrònica dels àtoms d'un determinat element químic acaba amb quatre electrons en els orbitals p del tercer nivell.
- Indiqueu raonadament el nombre d'electrons d'aquest àtom i el nombre atòmic de l'element.
- Indiqueu el grup i el període de la taula periòdica al qual pertany.
- Justifiqueu quina és la càrrega previsible del seu ió més estable.
- Compareu la seva energia d'ionització amb la de l'element situat al lloc 20 de la taula periòdica.
4.- Escriu les configuracions electròniques de cadascun dels següents ions i els nombres quàntics dels electrons de l'últim subnivell energètic: Se2- , Al3+ .
5.- Per a l'emissió fotoelèctrica d'electrons d'una superfície de coure, la freqüència llindar és d'1,1.10 15 Hz. Quina serà l'energia cinètica màxima dels electrons emesos quan s'il·lumina el coure amb llum de 6 nm? I la velocitat?
Dades: h=6,626.10-34 J.s; massa de l'electró: 9,1.10- 31 Kg .
6.- Dels parells d'àtoms següents, indiqueu quin té major energia d'ionització: a) potassi i calci; b) sodi i rubidi; c) rubidi i estronci; d) silici i fòsfor; e) argó i kriptó.
7 .- Un electró excitat d'un àtom d'hidrogen retorna a l'estat fonamental i emet una radiació electromagnètica de 180 nm. Calculeu:
- la freqüència de la radiació;
- la diferència d'energia entre els dos nivells electrònics expressada en joules.
8.- Escriu les configuracions electròniques de cadascun dels següents ions i els nombres quàntics dels electrons de l'últim subnivell energètic: Cl - , Na + .
9.- L'ull humà pot arribar a detectar quantitats de 10-18 J d'energia electromagnètica. Quants fotons de 600 nm han d'arribar a l'ull per començar a notar la seva presència?
Dada: h=6,626.10-34 J.s
10.- Per a l'emissió fotoelèctrica d'electrons d'una superfície de coure, la freqüència llindar és d'1,1.1015 Hz. Quina serà l'energia cinètica màxima dels electrons emesos quan s'il·lumina el coure amb llum de 2 nm? I la velocitat?
Dades: h=6,626.10-34 J.s; massa de l'electró: 9,1.10- 31 Kg .
11.- Enuncia les propietats de l'efecte fotoelèctric.
12 .- Fes una llista de diferències entre metalls i no-metalls.
13.- Ordeneu els elements Na, K i Rb segons el volum atòmic i el potencial d'ionització, discutint les raons que determinen aquest ordre.
14.-
- Explica quina informació es pot obtenir a partir de la configuració electrònica d'un element.
- Què explica el model atòmic quàntic?
15.- L'energia d'ionització de l'hidrogen és de 1,31 MJ/mol. Indiqueu, raonant-ho, després de fer els càlculs necessaris, si els raigs X, la longitud d'ona dels quals és 0,50 nm, incidint sobre àtoms d'hidrogen gasós i en estat fonamental, provocaran la seva ionització.
Dada: h = 6,63 x 10-34 J.s
16.-
a) Escriviu la configuració electrònica del Na + i del F - i els números quàntics de l'últim nivell energètic.
b) Indiqueu raonadament quin té major volum atòmic.
17.-
a) Definiu grup i període d'elements en la Taula Periòdica.
b) Quines són les propietats atòmiques més importants que són periòdiques?
c) Definiu què s'entén per afinitat electrònica.
Enllaç químic
1.- Indiqueu, raonadament, si la unió entre els següents elements és iònica o és covalent:
a) brom i potassi; b) oxigen i clor; c)hidrogen i sofre; d) carboni i oxigen; e) sofre i magnesi.
2.- Segons la teoria de la repulsió dels electrons de valència,
- Indica la geometria de les molècules següents: CS2 , H2S, SO2
- Justifica el caràcter polar o apolar de les molècules anteriors.
3.- D'acord amb la teoria de la repulsió dels parells d'electrons de valència:
a) Indiqueu justificadament la geometria de les molècules de triclorur de bor i de triclorur de fòsfor.
b) Raoneu quina de los dues molècules tindrà el moment dipolar més gran.
Dades: nombres atòmics: B = 5; Cl = 17; P = 15
4.- Explica el tipus d'enllaç i xarxa cristal·lina de les següents substàncies, comentant les propietats que fàcilment poden relacionar-se amb elles: gel, clorur de sodi, sodi, grafit i diamant
5.-
a) Escriviu les estructures de Lewis de les següents substàncies: PH3 , N2 , OF2 , CH3OH, H2SO4 .
b) Quines molècules tenen dobles o triples enllaços?
6.- Segons el model de repulsió de parells d'electrons, explica la geometria de les següents molècules i explica són polars o no: SiH3F, SCl2 , BeH2, HCN, HClO.
7.-
a) Explica les propietats de l'enllaç iònic.
b) Quin tipus d'enllaç hi ha en les següents substàncies: clor, cristall de clorur de sodi, tetraclorur de carboni. Ordena'ls per ordre creixent de punt de fusió
8.- La configuració electrònica d'un element X en estat fonamental és: 1s2 2 s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2 .
a) Indica en quin grup i en quin període de la taula periòdica es troba.
b) Quin tipus de sòlid forma quan reacciona amb oxigen? Escriu la fórmula del compost que es forma.
c) Quines propietats té el sòlid anterior referents a la temperatura de fusió i a la conductivitat elèctrica en estat fos?
9.- Explica, raonadament, quina molècula és més polar: CH4 o NH3
10.- A 272K el magnesi, l'aigua i el diamant són sòlids, però les característiques dels seus recicles és molt diferent. Expliqueu els tipus de cristalls que formen i deduir algunes de les propietats relacionades amb l'estructura.
11.- Utilitzant del model RPECV, indiqueu la geometria de les espècies químiques: CHCl3 , SiF4 i BF3. Quina o quines de les molècules són polars? Raoneu-ho.
12.-
a) Explica les propietats de les dues formes al.lotròpiques del carboni, diamant i grafit.
b) Explica les diferències que hi ha entre l'enllaç metàl·lic i l'enllaç iònic.
13.- Raoneu els fets experimentals següents:
- El punt de fusió del iode és més gran que el del fluor.
- L'aigua té un punt d'ebullició anormalment alt comparat amb el dels hidrurs dels altres elements del seu grup.
- El clorur de potassi fos condueix el corrent elèctric.
- El diamant és el mineral més dur que es coneix.
14.-
a) Escriviu les configuracions electròniques dels àtoms: A(Z=19) i B(Z=17).
b) Indiqueu, raonant-ho, el tipus d'enllaç que es formarà quan es combinin A i B i B i B.
c) Indiqueu, raonant-ho, si les dues espècies químiques de l'apartat b) són solubles en aigua.
15.-
a) Explica les propietats de l'enllaç iònic.
b) Digues el tipus d'enllaç que hi ha en les següents substàncies i ordena-les per punt de fusió creixent: clor, cristall de clorur de sodi, tetraclorur de carboni.
16.- Escriviu les estructures de Lewis, justifiqueu la geometria i predigueu si tenen polaritat o no les següents molècules: NCl3, CH3Cl, BF3.
18.- Tenint en compte les propietats que s'indiquen, expliqueu, raonant-ho, el tipus d'enllaç a les xarxes cristal·lines de les substàncies següents:
- Substància A: És conductora de l'electricitat, tant en estat sòlid com fosa.
- Substància B: Sòlid de punt de fusió elevat. Fosa i en dissolució condueix el corrent elèctric. No el condueix en estat sòlid.
- Substància C: Sòlid de punt de fusió molt elevat. No condueix el corrent elèctric ni en estat sòlid ni fosa.
- Substància D: El seu punt de fusió és molt baix.
19.- De les espècies químiques següents, Cu, S8, KBr, C (diamant), indiqueu raonant-ho:
- El tipus de cristalls que formen.
- Les espècies químiques conductores en fase sòlida, les conductores en dissolució i les solubles en aigua.
Gasos
1.- Una mescla de 17,604 g de CO2, 4,813 g de metà i 5,602 g de CO, exerceix una pressió de 800 mm de Hg. Calculeu la pressió parcial de cada component.
Sol.: CO2: 355 mm ; CH4: 267 mm ; CO: 178 mm
2.- Una mescla d'1 g de diòxid de carboni i 4 g de monòxid de carboni està en un recipient a 17ºC i 10 4 Pa. Calculeu:
a) El volum de la mescla,
b) La pressió parcial de cada gas.
3.- Si en un recipient de 8,2 L a 15ºC de temperatura tenim una mescla ideal de 7 g de N2 i 4 g d'O2, quina serà la pressió total? I quina la pressió parcial de cada component?
4.- Un recipient tancat de 500 cm3 , a 300 K, conté 6,40 x 10- 3 g d'oxigen, 0.02 g d'argó i 0,10 g de metà. Calculeu la pressió total exercida per la mescla i la pressió parcial de cada un dels seus components.
5.- L'aire conté un 21% en volum d'O2 . Calcula quantes molècules d'O2 entren als pulmons en una aspiració forta, si la pressió atmosfèrica és de 1,01x105 Pa i la temperatura és de 20ºC .
Dada : En una aspiració forta s'inhala aproximadament 1 dm3 d'aire.
6.- Una mescla de gasos a la pressió de 10 4 Pa i 300 K conté un 10% en massa d'etè, un 10% de propà i la resta d'oxigen. Calculeu la pressió parcial de cada gas i la pressió total.
7.- (S) Dos recipients de vidre tenen el mateix volum. L'un conté hidrogen i l'altre diòxid de carboni. Si es troben a la mateixa temperatura i pressió, compareu:
a) El nombre de molècules dels dos gasos.
b) La massa dels dos gasos.
Dades: Masses atòmiques: H: 1; C: 12; O:16
8.- (S) Tenint en compte que la pressió ambiental disminueix amb l'alçada. Indiqueu raonadament si l'aigua bullirà a temperatura igual, superior o inferior a nivell del mar que al cim de l'Everest.
9.- La densitat d'un gas en c.n. és 2,59 g/dm3 . Calculeu la seva massa molecular.
10.- Suposant que l'aire és aproximadament conté un 21% d'oxigen i un 79% de nitrogen. Calculeu la densitat de l'aire a 20ºC i 1 atm.
Dissolucions
1.-
a) Quants mL d'àcid clorhídric de densitat 1,19 g/cm3 i 36% en massa són necessaris per preparar 1 L de dissolució 2 mol/dm 3 ?
b) Calculeu el nombre de ions totals que existeixen en la dissolució.
Sol.: a) 170,2 mL; b) 2,4x10 24 ions
2.- Calcula els grams d'àcid nítric que contenen 10 ml d'una solució aquosa comercial que conté el 60% en massa d'àcid nítric i té una densitat de 1,38 g/cm3 .
3.- A 50 ml d'una solució 0,2 M de carbonat de sodi en aigua, hi hem afegit 450 ml d'aigua. Calculeu la nova concentració de la solució.
4.- Hem diluït una solució de clorur de potassi en aigua del 10% en massa afegint 100 mL d'aigua a 400 g de solució. Quina molalitat tindrà la solució diluïda?
Sol. : 1,17 mol/kg
5.- Calcula la molalitat d'una dissolució obtinguda en barrejar 250 g d'una dissolució aquosa del 2,5% en massa de sulfat de coure (II) (CuSO4) en aigua, amb 250 g d'una altra solució aquosa d'aquesta sal, del 5%.
Sol. : 0,24 mol/kg
6.-
a) Quants mL d'àcid clorhídric de densitat 1,19 g/cm3 i 36% en massa són necessaris per preparar 1 L de dissolució 2 mol/dm3?
b) Calculeu el nombre de ions totals que existeixen en la dissolució.
Sol.: a) 170,2 mL; b) 2,4x10 24 ions
7.- Calcula:
a) La quantitat de nitrat de potassi que podrem dissoldre en 200 g d'aigua a 70ºC .
Sol. : 260 g
b) La quantitat d'aquesta sal que precipitarà quan es refredi la solució anterior fins a 20ºC .
Sol. : 204 g
8.- Hem preparat una dissolució saturada de nitrat de potassi en aigua a 30ºC , barrejant 200 g d'aigua amb la quantitat de sal necessària. Després hem escalfat la dissolució fins a 60ºC . Calcula la quantitat addicional de sal que hi podrem dissoldre. Suposa que no s'ha evaporat gens d'aigua mentre l'escalfaves.
Sol. : 120 g
9.- Hem preparat una dissolució de nitrat de potassi en aigua a 60ºC del 40% en massa. Està saturada, aquesta dissolució?
Sol. : No (a 60ºC en 60 g d'aigua es poden dissoldre fins 60 g de KNO3)
10.- Hem preparat 100 g de dissolució de nitrat de potassi en aigua, del 35% en massa, a 50ºC . Després hem refredat aquesta dissolució fins a 20ºC .
a) Quina quantitat de sal precipitarà en refredar-la? Sol. : 16,8 g
b) Quin percentatge en massa presentarà la nova dissolució? Sol. : 21,9%
11.- Quan es barregen 4 g d'hidròxid de sodi amb 96 mL d'aigua, obtenint una dissolució?:
a) 1 mol/dm 3 c) 4,1% en massa
b) 4% en massa d) 41,7 g/dm 3
Sol. : b
12.- Per tal de preparar 250 g d'una dissolució de clorur de sodi del 5% en massa en aigua necessitem:
a) 5 g de clorur de sodi i 250 g d'aigua c) 12,5 g de clorur de sodi i 250 g d'aigua
b) 5 g de clorur de sodi i 245 g d'aigua d) 12,5 g de clorur de sodi i 237,5 g d'aigua
Sol. : d
13.- En dissoldre 2 g de clorur de sodi i 8 g de clorur de potassi en 190 g d'aigua hem obtingut una dissolució que presenta la composició següent:
a) 0,2 g/dm 3 de NaCl i 0,8 g/dm3 de KCl
b) 1% en massa de NaCl i 4% en massa de KCl
c) 1,04% en massa de NaCl i 40,4% en massa de KCl
b) 1,05% en massa de NaCl i 4,2% en massa de KCl
Sol. : b
14.- Una dissolució 2 mol/dm3 de clorur de sodi en aigua:
a) Té la mateixa composició que una dissolució 2 mol/kg d'aquesta mateixa sal en aigua, perquè 1 kg d'aigua ocupa un volum de 1 L .
b) És més concentrada que una dissolució 2 mol/kg d'aquesta mateixa sal en aigua.
c) És menys concentrada que una dissolució 2 mol/kg d'aquesta mateixa sal en aigua.
d) És molt més concentrada que una dissolució 2 mol/kg d'aquesta mateixa sal en aigua.
Sol. : b
15.- Si refredem una dissolució saturada d'una sal en aigua:
a) Sempre hi observarem que gran part del solut precipita.
b) Hi observarem que precipita una mica de solut: la quantitat exacta dependrà del canvi de temperatura que experimenti la solució.
c) Hi observarem que la dissolució s'enterboleix.
d) Pot ser que no hi observem cap canvi.
Sol. : b
16.- Si refredem una solució saturada de clorur de sodi que està a 40ºC fins a 20ºC:
a) Precipitarà pràcticament tot el solut. c) Precipitarà una part del solut.
b) Precipitarà la meitat del solut. d) No precipitarà gens de solut.
Sol. : c (molt poc)
17.- Una dissolució 0,5 mol/dm 3 de fosfat de sodi (Na3PO4) conté:
a) 0,5 mol/dm 3 d'ions de sodi c) 1,5 mol/dm 3 d'ions de sodi
b) 0,5 mol/dm 3 d'ions d'oxigen d) 1,5 mol/dm 3 d'ions de fòsfor
Sol. : c
Formulació orgànica
1.- Formuleu
- 4,4-dietil-2,3-dimetil octà 1-etil-2-metil benzè
- 2,4-hexanodiona 2,3-dimetil pentanal
- 4-penten-2-in-1-ol dipropil èter
- àcid 4-hidroxi-2-penten-1-oic metanoat de potassi
- 3-clor pentilamina 5-heptenamida
- 4-hexenonitril 2-heptè
- àcid 2-amino propanoic 3,4-octadiè
- ciclopentà 2-metil-3-heptí
- etanol 1,2-difluorobenzè
- toluè (metilbenzé) 1-brom-2-octen-4,6-dií
- butanal propanona
- metil etil èter 5-octen-2-ol
- àcid 2-metilhexanoic 3-oxohexanodial
- 2-metoxi-3-nonen-4-ona 2-clor-7-metilnaftalè
- 3-etil-5-isopropiloctà 7-etil-7-octen-1,3-dií
- 2-hepten-5-í 1,4-dietilbenzè
- 1-etil-8-metilfenantrè etanol
- 2-etil-4-metil-3-hexen-1-ol 4-octen-6-in-3-ol
- 4-metil-2-iodofenol dimetil èter
- 2-butinal 2,5,6-nonanotriona
- 2-bromo-3-pentanona àcid propanodioic (àcid malònic)
- 2-propanona 4-oxo-5-propil-2-heptendial
- 3,3-dimetil-2,4-hexadiona 4-oxo-5-propil-2-heptenodial
- àcid 6-propil-6-octen-4-inoic 7-etil-3-metil-5-propildecà
- 1,3-hexadiè etanoat d'etil
- 2-hexen-4-í 1,4-dipropilbenzè
- 1,1,1-tricloroetà 3-fluoro-1-pentè
- 1-butanol fenol
- 4-hexenal 2-hexanona
- dietil èter 4-oxohexanal
- àcid 3-hidroxibutanoic àcid etanodioic
- propanoat de metil trimetilamina
- àcid 3-aminohexanoic 2-metilbutanamida
- pentannitril fenilamina
- 3-amino-2-pentanol
2.- Anomeneu
- CH3 -COOCH3
- CH2OH-CO-CH2 -CHO
- CH2 =CH-CH2 -NH2
- CH3 -CH2 -CH2 -CN
- CH3 -O-CH2 -CH3
- CH2 =CH-CH3
- CH3 -COOH
- CH3 -CH2OH
- CH 2 =CH-CH2 -NH-CH3
- CH3 -CO-CO-CN
- CH3 -CHOH-COOH
- CH3 -CH2 -CH2 -CH2 -CHCl-CHBr2
- CH3 -CH2 -CH=CH-CH2 -CH2 -CH3
- OHC-CH=CH-CHO
- CH3 -CHOH-CH3
- CH3 -CHO
- CH2 =CH-CHCl-CO-CH3
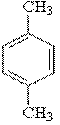
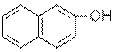
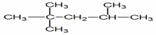
Càlculs estequiomètrics
1.- Una mescla de gasos a la pressió de 104 Pa i a 300 K conté un 10% en massa d'acetilè (etí), un 10% en massa de metà i la resta d'oxigen. a) Calculeu la pressió parcial de l'oxigen. b) Si la mescla està continguda en un recipient de 1 dm3 i es fa saltar una guspira elèctrica, els gasos reaccionen i s'obté diòxid de carboni i aigua. Calculeu la pressió total a l'interior del recipient, si la temperatura final és de 600 K.
2.- Es té un aliatge d'alumini i magnesi, la composició de la qual es vol saber. Una mostra de 0,70 g d'aliatge es tracta amb un excés d'àcid clorhídric diluït. L'hidrogen obtingut ocupa un volum de 846,7 cm3 a 300 K i 105 Pa. Calculeu la composició de l'aliatge.
3.-
a) Es disposa de 1 g de HCl, 1 g de H2SO4 i 1 g de H3PO4 . Quin necessita major quantitat de NaOH per neutralitzar-se?
b) Si es té una mostra de 2 g de NaOH impurificat amb NaCl, es dissol en aigua i es fa reaccionar amb HCl 2 mol/dm3 , es necessiten 20 mL de la solució àcida per fer la neutralització. Calculeu el percentatge de NaOH a la mostra original.
Sol.: b) 80%
4.- Es crema una mescla equimolar de propà i butà que conté 88 g de propà.
a) Escriu les equacions de combustió.
b) Calculeu els mols de cada combustible.
c) Calculeu el volum d'aire en condicions normals necessari per cremar l'esmentada mescla.
Dada: L'aire conté un 20% en volum d'oxigen.
5.- El zinc reacciona amb l'àcid clorhídric diluït i s'obté clorur de zinc que queda dissolt a l'aigua. En un vas de precipitats que conté 3,50 g de zinc s'hi afegeixen 200 cm3 d'àcid clorhídric del 25,8% en massa i densitat 1,14 g/cm3 .
a) Escriviu i igualeu l'equació corresponent a la reacció que es produeix.
b) Indiqueu, realitzant els càlculs pertinents, quin és el reactiu limitant.
c) Calculeu el volum d'hidrogen obtingut, mesurat a 298 K i 1,01x105 Pa.
6.- Una dissolució d'àcid nítric de densitat desconeguda es dilueix 10 vegades. Una mostra de 20 cm3 d'aquest àcid diluït necessita 22,8 cm3 d'una dissolució d'hidròxid de sodi de concentració 0,5 mol/dm3 per neutralitzar-se. Calculeu la densitat de la dissolució d'àcid nítric inicial.
7.- Tenim 20 l de benzè. Aquest compost, a temperatura ambient, és un líquid de densitat 878 kg/m3 . Es crema amb l' oxigen de l'aire per formar diòxid de carboni i aigua. Calcular:
a) Molècules de benzè que hi ha contingudes en aquest 20 litres de benzè.
b) Volum d'aire, a 27 o C y 1 atm, necessari per a la combustió total del benzè.
Nota: considerar que l'aire conté un 20% d'oxigen.
8.- Es fan reaccionar 200 g de pedra calcària que conté un 60% de carbonat de calci amb una dissolució d'àcid clorhídric del 30% en pes i densitat 1,15 g/cm3 . Els productes d'aquesta reacció són clorur de calci, diòxid de carboni i aigua. Calcular:
a) Quantitat de clorur de calci obtingut.
b) Volum de dissolució d'àcid clorhídric que ha reaccionat.
c) Molaritat i molalitat de la dissolució àcida.
d) Volum de dissolució d'àcid clorhídric necessari per neutralitzar 30 cm 3 de dissolució d'hidròxid de sodi 0,25 M .
9.- A 2000 o C y 1 atm es fan reaccionar hidrogen i oxigen per obtenir aigua. Si inicialment hi ha 20 l de hidrogen i 200 l d'aire. Calcular el volum total de gas que hi haurà al final de la reacció.
Nota: considereu que l'aire conté un 20% d'oxigen i que la resta és nitrogen (aquest s'ha de tenir en compte quan es calculen els gasos que hi ha al final de la reacció).
10.- Una mescla de gasos a la pressió de 104 Pa i 300K conté un 10% en massa d'etè, un 10% de propà i la resta d'oxigen.
a) Calcular la pressió parcial de cada gas.
Si aquesta mescla està continguda en un recipient de 1 l i es fa saltar una guspira elèctrica al seu interior, els gasos reaccionen i s'obté diòxid de carboni i vapor d'aigua.
b) Calcular la pressió a l'interior del recipient una vegada que els gasos hi hagin reaccionat, si la temperatura puja a 500K.
Dada: Masses moleculars (g/mol): C:12, H:1; O:16; Ca:40; Cl:35,5
Energia de les reaccions químiques
1.- En cada cas, calcula el valor que falta, q, W o D E .
- q = 100 J, W = -20 J
- W = -50 J, D E = -120 J
2.- Quanta energia cal per evaporar 5 mol d'aigua? El calor molar d'ebullició de l'aigua a 100ºC és 40.600 J/ mol.
3.- Un sistema exerceix un treball de 250.000 J contra la pressió atmosfèrica. Si el volum inicial del sistema era de 20 m3 , quin en serà el volum final?
4.- Segons la reacció: CH4(g) + 2 O2(g) ---- CO2(g) + 2 H2O (l) , en cremar 16 g de metà a pressió constant es transfereix una quantitat de calor de 1.112 kJ cap a l'entorn, un cop la temperatura ha tornat al valor inicial de 25ºC . Podries escriure'n l'equació termoquímica completa?
5.- Les entalpies estàndard de formació del butà, l'aigua líquida i el diòxid de carboni són, respectivament, –124,7, –285,5 i –393,5 kJ/ mol.
a) Escriviu la reacció de combustió del butà.
b) Calculeu l'entalpia estàndard de combustió del butà.
c) Trobeu la quantitat d'energia calorífica que s'obté en cremar tot el butà d'una bombona ( 12,5 kg ).
d) Si aquesta energia s'utilitza per escalfar aigua des de 10 °C fins a 40 °C , calculeu la quantitat d'aigua calenta que es podria obtenir.
Dades: masses atòmiques: H = 1, C = 12; capacitat calorífica de l'aigua: 4,18 kJ/ kg.K
6.- Tens les equacions termoquímiques següents:
C (graf) + ½ O 2(g) ---- CO (g) D H = -110 kJ/mol
CO(g) + ½ O 2(g) ---- CO 2(g) D H = -283 kJ/mol
Troba el valor de D H de la reacció: C (graf) + O 2(g) ---- CO 2(g)
7.- Determineu la quantitat de calor necessària per transformar 20 g de gel a -10ºC en 20 g de vapor d'aigua a 100ºC si se sap que la calor de fusió del gel és 334 kJ/kg i la calor de vaporització de l'aigua és 2255 kJ/kg.
Dades : c e (gel) = 2090 J/kg.K; c e (aigua) = 4180 J/kg.K
8.- L'equació termoquímica corresponent a la reacció de neutralització en una dissolució aquosa és:
H + (aq) + OH - (aq) ---- H 2 O (l) DH o = -54 kJ/mol
- Trobeu quina quantitat de calor correspon a la neutralització de 25 cm 3 d'àcid clorhídric 2 mol/dm 3 amb 25 cm 3 d'hidròxid de sodi 2 mol/dm3 .
- La dissolució s'escalfarà o es refredarà?
Si la massa de la dissolució anterior és de 52 g i estava a 20ºC , calculeu la temperatura final de la dissolució.
9.- 5,0 g d'una mescla de carbonat i hidrogencarbonat de calci s'escalfen fins a aconseguir la descomposició total dels esmentats compostos d'acord amb les reaccions químiques:
- Ca(HCO3)2(s) ---- CaO (s) + 2 CO2(g) + H2O (g)
- CaCO3(s) ---- CaO (s) + CO2(g)
Si sabem que s'alliberen 0,44 g d'aigua en forma de vapor,
a) Indiqueu quina és la composició en % en massa de la mescla.
b) Calculeu la calor que caldrà subministrar per descompondre el carbonat de calci present.
Dades : D H o f : CO2(g) = -393,5 kJ/mol; D H o f : CaCO3(s) = -1206 kJ/mol; D H o f : CaO (s) = -635 kJ/mol
10.- La hidrazina és un combustible per a coets. Si un coet utilitza hidrazina com a combustible i peròxid d'hidrogen com a comburent es produeix la reacció següent:
NH2-NH2 + 2 H-O-O-H ---- N2 + 4 H-O-H
Si les energies d'enllaç expressades en kJ/mol són: N-H: 391; N-N: 159; O-H: 463; N2: 945 i O-O: 143. Calculeu:
- El canvi d'entalpia de la reacció,
- La calor alliberada a pressió constant, si en la combustió anterior s'utilitzen 640 g d'hidrazina.
11.- Les plantes verds sintetitzen glucosa mitjançant la reacció de fotosíntesi següent:
6 CO2(g) + 6 H2O (l) ---- C6H12O6(s) + 6 O2(g) D H o = 2813 kJ/mol
a) Calculeu l'energia necessària per obtenir 1 g de glucosa.
b) Calculeu l'entalpia de formació de la glucosa i justifiqueu-ne el signe.
Dades : D H o f : CO2(g) = -393,5 kJ/mol; D H o f : H2O (l) = -285,5 kJ/mol
12.-
a) Determineu l'energia en forma de calor que es desprèn en la combustió de 1 litre de butà a 25ºC i 1 atm de pressió.
b) Si la calor emesa s'aprofita per escalfar aigua, determineu la variació de temperatura de 1 litre d'aigua, inicialment a 25ºC , si el rendiment del procés d'intercanvi de calor és del 80%.
Dades: D Ho f : CO2(g) = -393,5 kJ/mol; D Ho f : H2O (l) = -285,5 kJ/mol, D H o f : butà(g): -124,2 kJ/mol; C p (H2O (l) ) = 4,18 J/g.K
Cinètica
1.-
a) Raona si l'afirmació següent és vertadera o falsa: “les reaccions molt exotèrmiques no necessiten energia d'activació”.
b) Justifiqueu per què és aconsellable mastegar bé els aliments per fer després una bona digestió.
c) Definiu catalitzador.
d) Expliqueu què és el mecanisme d'una reacció.
2.- Quines de les següents afirmacions són certes?
- Un catalitzador augmenta el rendiment d'una reacció.
- Un catalitzador augmenta la velocitat d'una reacció.
- Un catalitzador es manté inalterat mentre té lloc el procés que catalitza.
- El catalitzador es consumeix parcialment durant la reacció.
3.- La velocitat de les reaccions creix amb la temperatura. Sovint, en incrementar la temperatura uns 10ºC , la velocitat es duplica. De segur que t'han di moltes vegades que guardis el suc de taronja a la nevera perquè la vitamina C s'oxida amb l'oxigen de l'aire. Té una explicació cinètica, aquest fet?
4.- Representa el diagrama d'energia d'una reacció que tingui lloc a través de tres processos elementals, i que el segon sigui l'etapa limitant.
5.- La velocitat d'una reacció creix amb la temperatura. Quina relació presenta aquest fet amb el funcionament de l'olla de pressió?.
6.- La llei de la velocitat de la reacció 2 A + 2 B ---- C + 2 D és la següent: v = k(A)(B). Digues quines de les afirmacions següents són certes:
- És una reacció de primer ordre.
- És una reacció de primer ordre respecte de A.
- L'ordre total de la reacció és 4.
- Si doblem la concentració de A i mantenim constant la de B, la velocitat de la reacció serà quatre vegades més gran.
7.- Quines de les següents afirmacions són falses:
- L'etapa limitant d'una reacció és la més lenta.
- La contant de velocitat d'una reacció depèn de la temperatura.
- La velocitat d'una reacció catalitzada depèn de la concentració del catalitzador.
- La constant de velocitat d'una reacció no depèn de la concentració dels reactius.
- L'energia d'activació disminueix quan augmenta la concentració dels reactius.
Equilibri químic
1.- Quan 1 mol d'alcohol etílic pur es mescla amb 1 mol d'àcid acètic a temperatura ambient, la mescla en equilibri conté 2/3 mols d'ester i 2/3 mols d'aigua. a) Calculeu la constant d'equilibri. b) Quants mols d'ester hi ha a l'equilibri quan es mesclen 3 mols d'alcohol i 1 mol d'àcid? Totes les substàncies són líquides a la temperatura de la reacció.
Sol.: a) 4; b) 0,9
2.- A 27ºC i 1 atm., el N2O4 està dissociat en un 20% en NO2. a) Calculeu k p i el percentatge de dissociació del N2O4 a 27ºC i 0,1 atm. b) Quin és el grau de dissociació d'una mostra de 69 g de N2O4 que es troba en un recipient tancat de 20 L a 27ºC .
Sol.: a) 0,17 atm, 55%; b) 19%
3.- En un recipient on prèviament s'ha fet el buit hem introduït 2 mol/L de NOCl. Després l'hem escalfat fins a 735 K. La mescla en equilibri contenia 1,34 mol/L de NOCl que no s'havien descompost. Calcula Kc .
Equació: 2 NOCl(g) ---- 2 NO(g) + Cl2 (g)
4.- A 50ºC , el tetraòxid de dinitrogen es dissocia parcialment en diòxid de nitrogen.
N2O4 (g) ---- 2 NO2 (g)
La constant Kc d'aquest equilibri a 50ºC val 2,64.10-2 . Determina quina serà la concentració de cadascun dels gasos a l'equilibri si inicialment hi havia 0,500 mol/L de N2O4.
5.- A 1000 K el iode es dissocia parcialment en iode atòmic: I2 (g) ---- 2 I(g). La constant d'equilibri és igual a 3,76.10 -5 mol/L. En un recipient de 200 cm 3 s'introdueixen 2,54 g de iode; el recipient es tanca i s'escalfa fins a aconseguir 1000 K. Calcula la quantitat de iode que quedarà sense dissociar-se en el medi de reacció.
6.- La constant d'equilibri, Kc , de la reacció: N2O4 (g) ---- 2 NO2 (g) a 25ºC , val 6,83.10-2 . Calcula Kp .
7.- A 450ºC el iodur d'hidrogen està dissociat un 22%.
- Quant val la constant Kc de l'equilibri: HI(g) ---- ½ I2 (g) + ½ H2 (g)?
- Quant val la Kp de l'equilibri: 2 HI(g) ---- I2 (g) + H2 (g)?
8.- Quins dels següents equilibris no es veuen afectats per un canvi de pressió?
- HI(g) ---- ½ I2 (g) + ½ H2 (g)
- N2O4 (g) ---- 2 NO2 (g)
- 2 NOCl(g) ---- 2 NO(g) + Cl2 (g)
- CO(g) + H2O(g) ---- CO2 (g) + H2 (g)
9.- Quan 1 mol d'alcohol etílic pur es mescla amb 1 mol d'àcid acètic a temperatura ambient, la mescla en equilibri conté 2/3 mols d'ester i 2/3 mols d'aigua. a) Calculeu la constant d'equilibri. b) Quants mols d'ester hi ha a l'equilibri quan es mesclen 3 mols d'alcohol i 1 mol d'àcid? Totes les substàncies són líquides a la temperatura de la reacció.
Sol.: a) 4; b) 0,9
10. Per a la reacció d'esterificació que té lloc entre l'àcid propanoic i l'etanol per donar propanoat d'etil i aigua (totes les espècies són líquides):
a) Escriviu l'equació de la reacció.
b) Si la constant d'equilibri de la reacció és Kc = 16,0, trobeu les concentracions a l'equilibri quan la reacció s'inicia amb 1 mol de cada reactiu en un recipient d'1 litre de capacitat.
c) Escriviu i anomeneu algun isòmer de l'èster format.
11.- A 27ºC i 1 atm., el N2O4 està dissociat en un 20% en NO2 . a) Calculeu k p i el percentatge de dissociació del N2O4 a 27ºC i 0,1 atm. b) Quin és el grau de dissociació d'una mostra de 69 g de N2O4 que es troba en un recipient tancat de 20 L a 27ºC .
Sol.: a) 0,17 atm, 55%; b) 19%
12.- El monòxid de carboni reacciona amb el vapor d'aigua segons:
CO(g) + H2O(g) ---- CO2 (g) + H2 (g)
Un recipient de 2,00 dm 3 conté en equilibri 0,10 mols de CO, 0,13 mols de H2O, 0,09 mols de CO2 i 0,09 mols de H2.
- Calculeu la constant d'equilibri.
- Sense modificar la temperatura ni el volum del sistema en equilibri, s'hi afegeixen 0,01 mols de CO2 al recipient. El sistema evoluciona fins a aconseguir un nou estat d'equilibri. Calculeu les noves concentracions de les quatre espècies químiques a l'equilibri.
13.- En escalfar el diòxid de nitrogen en un recipient tancat, es descompon parcialment en monòxid de nitrogen i oxigen, segons la reacció en equilibri:
2 NO2 (g) ---- 2 NO(g) + O2 (g)
Un recipient tancat conté inicialment 0,0184 mol/dm 3 de NO2 S'escalfa fins a aconseguir la temperatura de 327ºC i, una vegada assolit l'equilibri, es troba, mitjançant una anàlisi, que la concentració de NO2 (g) és de 0,0146 mol/dm 3 . Trobeu la Kc per a la reacció anterior.
14.- S'introdueixen 1,5 mols de pentaclorur de fòsfor en un recipient d' 1 litre i s'escalfen fins 250 ºC ; un 53% de pentaclorur de fòsfor es dissocia en triclorur de fòsfor i clor, assolint l'estat d'equilibri.
a) Calculeu la Kc.
b) Calculeu les pressions parcials dels components de la mescla, la pressió total i la fracció molar de cada component.
Reaccions de transferència de protons
1.- Calculeu el grau d'hidròlisi d'una dissolució 1 mol/dm3 de NH4Cl.
Dada: kb (amoníac) = 10 -4,8
2.- Una mostra de 40,0 cm3 d'àcid acètic 0,01 mol/dm3 es valora amb NaOH 0,02 mol/dm3 . Calculeu el pH després de l'addició de: a) 3 cm3 de NaOH; b) 10,0 cm3 de NaOH; c) 20,0 cm3 de NaOH; d) 30 cm3 de NaOH.
Dada: ka (àcid acètic) = 10 -4,8
Sol.: a) 4; b) 4,74; c) 8,28; d) 11.46.
3.- Calcula la concentració d'ions [H3O+] d'una dissolució aquosa d'àcid cianhídric (HCN) de concentració 0,2 mol/dm3 , si la K a és 4,9.10 -10 .
4.- En una dissolució aquosa 0,10 mol/L de HF s'ha determinat la concentració de [H3O+], que és 0,008 M . Calcula la constant d'acidesa de l'àcid fluorhídric.
5.- Calcula el pH i el pOH d'una dissolució aquosa d'amoníac 0,1 M . Kb = 1,8.10 -5 .
6.- Un àcid monopròtic està ionitzat un 10% en solució. Quin és el pH d'una solució 0,10 mol/dm3 d'aquest àcid?
7.- Dues solucions aquoses tenen el mateix pH. La primera conté 1,00 mol/L de HIO3 (àcid feble), i la segona, 0,34 mol/L de HNO3. Calcula el grau d'ionització i el pK de l'àcid HIO3 .
8.- A 50 ml d'una solució de HCl de concentració 0,02 mol/L s'hi afegeix 30 ml d'una solució de Ba(OH)2 0,02 mol/L. Si l'evaporem a sequedat, quants mols de clorur de bari s'obtindran?
9.- Calcula el volum d'àcid clorhídric 0,1 mol/L necessari per neutralitzar 10 g d'hidròxid de sodi.
10.- Calcula el pH d'una solució en barrejar 20 cm3 de HCl 0,2 mol/L amb 30 cm3 de NaOH 0,1 mol/L.
11.- L'àcid nitrós és un àcid dèbil, amb una constant de dissociació Ka = 4,3 · 10–4.
a) Escriviu la reacció de neutralització de l'àcid nitrós amb l'hidròxid de bari.
b) Calculeu la concentració que ha de tenir una dissolució d'àcid nitrós si volem que el seu pH sigui igual al d'una dissolució d'àcid clorhídric 0,01 M .
c) Determineu la massa d'hidròxid de bari necessària per neutralitzar 10 cm3 de la dissolució d'àcid nitrós de l'apartat b).
Dades: masses atòmiques: H = 1, N = 14, O = 16, Ba = 137,3
12.- L'àcid ciànic (HCNO) i l'àcid cianhídric (HCN) són àcids febles monopròtics.
a) Calcula el pH d'una dissolució 0,05 M de cianur de sodi.
b) Si tenim 100 ml d'una solució 0,1M d'àcid cianhídric i 100 ml d'una dissolució d'àcid ciànic de la mateixa concentració. Quina requereix major quantitat d'hidròxid de sodi per neutralitzar-se?. Justifica la resposta.
Dades: K (HCNO ) = 2,2x10 -4 , K (HCN) = 7,2x10 -10
13.- En una dissolució aquosa 0,1M d'àcid acètic, l'àcid es troba ionitzat un 1,3% a 25ºC .
a) Calcula el nombre de mols de ions acetat i de ions hidroni existents en 100 cm 3 de dissolució.
b) Calcula la constant d'acidesa, k a , de dissociació de l'àcid acètic a 25ºC .
14.-
a) Disposem d'una dissolució aquosa d'amoníac que té un pH de 10,9. Indiqueu quina serà la concentració d'ió amoni i d'amoníac.
b) Una solució de sulfat d'amoni serà àcida, bàsica o neutra? Justifiqueu la resposta
15.-
a) Calculeu el pH de una dissolució formada al dissoldre 0,5 mols d'àcid acètic i 0,25 mols d'acetat de sodi fins a obtenir 200 cm3 de dissolució.
b) Calcula quina concentració ha de tenir una dissolució de HNO3 per tal de que el seu pH sigui igual que el pH de la dissolució anterior.
Dades: K (CH3COOH )=10 -4,8
16.- Una dissolució 0,1 M d'àcid fluorhídric té el mateix pH que una dissolució 8.10-3 M d'àcid nítric.
- Calcular el valor del pH.
- Calcular la constant d'acidesa de l'àcid fluorhídric.
Reaccions de transferència d'electrons
1.- Per 100 mL d'una dissolució 0,1 mol/dm3 de CuSO4 passa un corrent de 1,5 A durant 10 minuts, dipositant-se tot el coure. Part dels H + de l'aigua reaccionen per formar hidrogen (en el càtode). L'única reacció que es produeix a l'ànode és:
OH - (aq) – 2 e - ---- ½ O 2 + H + . Calculeu:
a) Temps que tarda en dipositar-se el coure.
b) Volum total de gasos que es desprenen a l'electròlisi.
c) pH al final de l'electròlisi.
Sol.: a) 1287s; b) 0,012; c) 0,7
2.- Per a la reacció següent: Cu (s) + Sn2+ (aq) ---- Cu2+ (aq) + Sn (s)
a) Justifiqueu si, en condicions estàndard, tindrà lloc tal com està escrita o en sentit contrari.
b) Expliqueu de quina manera es pot construir una pila en la qual tingui lloc aquesta reacció (en el sentit adequat). Indiqueu l'ànode, el càtode i el sentit del moviment dels electrons pel circuit extern.
c) Calculeu la força electromotriu estàndard de la pila.
Dades: E° (Cu2+/Cu) = 0,34 V, E° (Sn2+/Sn) = –0,14 V
3.- Es vol dipositar electrolíticament una capa de 0,005 mm d'or sobre una moneda metàl·lica que té una superfície total de 3 cm2. Per fer-ho s'introdueix la moneda en un bany que conté ions Au3+, i es connecta a un circuit pel qual circula un corrent de 0,1 A .
a) Indiqueu si la moneda haurà d'actuar com a ànode o com a càtode.
b) Escriviu la reacció que tindrà lloc a l'elèctrode.
c) Calculeu la massa d'or que cal dipositar.
d) Determineu el temps que haurà de circular el corrent.
Dades: masses atòmiques: Au = 197; Densitat de l'or = 19,3 g/cm3; 1 Faraday = 96 485 C/mol
4.- El dicromat de potassi reacciona amb el sulfat de ferro(II) en una dissolució que conté àcid sulfúric, per donar les sals corresponents de ferro(III) i crom(III).
a) Escriviu la reacció que té lloc i ajusteu-la pel mètode de l'ió-electró.
b) Indiqueu quins és l'espècie oxidant i quina la reductora.
c) Calculeu el volum de dissolució de dicromat de potassi 0,1 M necessari per reaccionar amb 150 mg de sulfat de ferro(II)
Dades : masses atòmiques: O = 16; H = 1; S = 32; K = 39; Fe = 55,8; Cr = 52.
5.- Si els potencials normals de reducció del Cu 2+ i del Cd 2+ són: Eº (Cu 2+ /Cu: +0,34 V; Eº (Cd 2+ /Cd): -0,40 V,
a) calculeu el potencial de la pila, indiqueu-ne el càtode i l'ànode i el sentit en què es mouen els electrons pel circuit exterior;
b) justifiqueu quin dels dos cations és més oxidant;
c) si aquesta pila produeix un corrent de 4,6 mA, calculeu el temps que durarà si el metall de l'ànode pesa 2 g .
Dades : 1 Faraday: 96500 C ; massa atòmica: Cd: 112,4.
6.- En electrolitzar una dissolució de clorur de coure(II) s'obté clor i coure. S'electrolitzen 500 ml d'una dissolució de clorur de coure (II) 0,1 M emprant un corrent de 5 A durant 30 minuts.
a) Escriviu les reaccions que tenen lloc als elèctrodes.
b) Calculeu la massa de coure i el volum de clor mesurat a 27ºC i 1 atm.
c) Calculeu la concentració, en mol/l de la dissolució de coure(II) en acabar el procés d'electròlisi.
Dades : F: 96500 C . Massa atòmica: Cu: 63,5
7.-
a) Expliqueu, de manera raonada, si l'ió dicromat en medi àcid serà capaç de provocar les oxidacions següents en condicions estàndard. Justifiqueu les respostes.
Ce 3+ ---- Ce 4+
Mn 2+ ---- MnO4 -
Fe 2+ ---- Fe 3+
b) En cas afirmatiu, ajusteu l'equació iònica de la reacció d'oxidació-reducció pel mètode de l'ió-electró
Dades : Eº(dicromat/Cr 3+ ): +1,36 V; Eº(Ce 4+ /Ce 3+ ): + 1,74 V; Eº(MnO 4 - /Mn 2+ ): +1,51 V; Eº(Fe 3+ /Fe 2+ ): +0,77 V
8.- Les següents reaccions redox incompletes requereixen un medi àcid
IO3 - (aq) + SO3 2- (aq) + ... ---- SO4 2- (aq) + I2 (aq) + ...
MnO4 - (aq) + NO2 - (aq) + ... ---- NO3 - (aq) + Mn 2+ (aq) + ...
- Completeu i igualeu cada una d'elles pel mètode de l'ió-electró.
- 10,0 cm3 d'una dissolució de iodat de potassi 0,001 mol/dm3 s'afegeixen a una solució àcida, que conté 0,200 g de sulfit de sodi. Calculeu la massa de iode obtinguda.
Dades: masses moleculars: S(32); O(16); Na(23); I(127).
9.- Es vol construir una pila basada en la reacció espontània:Zn(s) + 2 Fe 3+ (aq) ---- Zn 2+ (aq) + 2 Fe 2+ (aq)
- Dibuixeu un esquema de la pila basada en aquesta reacció. Indiqueu l'ànode, el càtode i el sentit del moviment d'electrons en el circuit exterior.
- Calculeu la seva fem estàndard.
Dades: Eº(Zn 2+ /Zn) = -0,76 V; Eº(Fe 3+ /Fe 2+ ) = +0,77 V
10.- Indiqueu si són veritables o falses les afirmacions següents:
- En solució aquosa i a 25ºC , els ions Fe 3+ oxiden els ions I - a I2.
- A 25ºC , l'àcid sulfúric diluït reacciona amb el coure i es desprèn hidrogen.
- El sodi és molt reductor, el fluor és un poderós oxidant
Dades: Eº(I2 /I - ) = -0,54 V; Eº(Fe 3+ /Fe 2+ ) = +0,77 V; Eº(H + /H2) = 0,00 V; Eº(Cu 2+ /Cu) = +0,34 V; Eº(Na + /Na) = -2,71 V; Eº(F2 /F - ) = +2,87 V
11.- En electrolitzar clorur de sodi fos, s'obté Cl2 al càtode. Per una cel·la electrolítica que conté NaCl fos es fa passar un corrent continu de 3 A durant 1 hora amb una tensió de 6 V.
- Escriviu les semireaccions que tenen lloc al càtode i a l'ànode i l'equació química corresponent al procés global.
- Calculeu la massa de Na obtinguda al càtode.
- Calculeu el volum de Cl2 (g) mesurat en c.n. que es desprèn a l'ànode.
- Trobeu el consum d'energia elèctrica expressat en kWh, suposant un rendiment del 100%.
Dades: Masses atòmiques: Na(23).
Reaccions de precipitació
1.- La solubilitat del Ag2CrO4 en aigua és 0,024 grams per litre. Calculeu la constant del producte de solubilitat.
Sol.: k ps = 1,4x10 -12
2.- A partir de quina concentració de SO4 2- (aquest ió s'afegeix en forma de sal sòlida i es suposa que el volum de la dissolució no varia) precipitarà el RaSO4 si s'afegeix a 500 mL d'una dissolució que conté 0,0001 mol de Ra 2+ ?
Dada: K ps (sulfat de radi) = 4x10 -11
Sol.: 2x10 -7 mol/dm3
3.- Una dissolució conté una concentració de ió Mg 2+ 0,001 mol/dm3 . Precipitarà el Mg(OH)2 si les concentracions de OH - en dissolució són: a) 10 -5 mol/dm3 ; b) 10-3 mol/dm3 . Raoneu la resposta.
Dada: K ps (hidròxid de magnesi) = 1,1x10 -4
4.- S'afegeix cromat de potassi sòlid a una dissolució 10- 3 M de clorur de bari i 10- 3 M de clorur d'estronci.
a) Justificar quina sal precipita primer.
b) Calcular la concentració d'ió cromat en el moment que comença a precipitar la primera sal.
c) Calcular la concentració de l'altre ió metàl·lic necessària per tal que precipitin els dos cromats.
Dades: Ks(cromat de bari)=10 -10 ; ks(cromat d'estronci)=10 -5
5.- Es mesclen 20 ml d'una dissolució 8.10 - 3 M d'hidròxid de potassi amb 80 ml d'una dissolució 6.10 - 2 M de triclorur d'alumini. Indicar, fent els càlculs pertinents, si es formarà precipitat d'hidròxid d'alumini.
Dada: Ks (hidròxid d'alumini)=10 -32
6.- El producte de solubilitat, a 25ºC , del sulfur de zinc és Ks = 2,9 x 10 -25 .
- Calculeu la solubilitat del sulfur de zinc en aigua pura, a 25ºC .
- Calculeu la solubilitat d'aquest sulfur en una solució 10-3 mol/dm3 de sulfur de sodi.
- Compareu tots dos resultats i traieu-ne conclusions.
7.- Calculeu la concentració d'ions Mg 2+ en una solució de pH = 12,41.
Dada: Ks (Mg(OH)2) = 5,7 x 10 -12
8.- A 25ºC , una solució saturada d'hidròxid de zinc conté 0,27 mg de Zn(OH)2 dissolts en cada dm3 de solució.
- Calculeu el producte de solubilitat d'aquest hidròxid.
- A 1 dm3 d'una solució de pH = 10, a 25ºC , s'hi afegeix, a poc a poc i agitant, 10 mg de clorur de zinc. Indiqueu, raonant-ho, després de fer els càlculs necessaris, si s'obtindrà un precipitat d'hidròxid de zinc.
Dades: Masses atòmiques: Zn (65,4); O(16); H(1); Cl(35,5)
9.- (S) Calculeu el nombre d'ions clorur i el nombre d'ions plata existents en 100 cm3 d'una solució saturada de clorur de plata.
Dades: Ks(clorur de plata) = 1,76 . 10 -10 ; N A = 6,02. 10 23
10.- (S) Es disposa d'una solució 0,1 M de clorur de calci i 0,01 M de clorur de magnesi a la qual s'afegeix lentament una dissolució d'hidròxid de sodi.
a) Indiqueu si precipitarà primer l'hidròxid de calci o el de magnesi.
b) Justifiqueu si es formarà precipitat d'hidròxid de calci quan el pH de la solució sigui igual a 10.
Dades: Ks (hidròxid de calci) = 5,5 . 10 -6 ; Ks (hidròxid de magnesi) = 1,1 . 10 -11
(S): Problemes trets de les proves de Selectivitat