Pila de Volta
771. Preliminares. —
Hasta los últimos años del siglo XVIII era desconocida la electridad dinámica; y son tan prodigiosos los descubrimientos y las aplicaciones que se han hecho en esto ramo del saber, que se explica la predilección de los sabios por su estudio, así como la curiosidad pública por conocer el origen de las pilas eléctricas.
772. Electricidad estática y dinámica. -
Al aproximar los conductores de la máquina de Holtz ó reuniéndolos por un alambre, se origina un flujo de electricidad que va del polo + al — en sentido de los potenciales decrecientes; flujo que se mantiene á expensas del trabajo efectuado por la mano que hace girar al disco. Otro tanto sucede si en vez del trabajo mecánico se transforma el trabajo químico ó calorífico para producir el flujo ó corriente eléctrica quo circula por el alambre que enlaza los dos polos de una pila, originándose la electricidad dinámica ó en movimiento, á diferencia de la que permanece estacionada sobre los conductores de las máquinas eléctricas. Resultan muy distintos, sin embargo, unos efectos de otros, aun cuando son debidos siempre al mismo agente eléctrico. Como vemos, para que se origine la corriente eléctrica, es necesario que exista una diferencia de potencial entre los dos conductores electrizados unidos por un tercero, y se comprendo que para que la referida diferencia se mantenga constante debe haber una causa, denominada fuerza electromotriz, que impide el restablecimiento del equilibrio eléctrico y sirve para medir la dicha diferencia de potencial.
De igual modo, en virtud del principio de la conservación de la energía, es indisponsable un gasto de la misma que equivalga á la desarrollada por la corriente.
Sorprende desde luego que la chispa en las máquinas eléctricas salta á considerable distancia entre los conductores, alcanzando cinco y seis decímetros en la máquina de Holtz, y en cambio, con pilas de mil y dos mil elementos cargados en tensión, la chispa entre los electrodos no pasa de una fracción de milímetro; sin embargo, la cantidad de electricidad que circula en una corriente de pocos pares es enorme comparada con las de las máquinas electrostáticas más potentes, y por esta razón se descompone el agua con la corriente de las primeras, y apenas pueden obtenerse unas burbujitas de gas hidrógeno y oxigeno con las cargas de las segundas
En la actualidad se expresan estos hechos diciendo que la diferencia de potencial en los conductores de las máquinas es muy grande, siendo poca esta diferencia de potencial entre los polos de la pila, aunque sea mucha la intensidad de la corriente. Se percibe muy bien esta diversidad de efectos, considerando un vaso de mucha altura lleno de agua; si practicamos un orificio pequeño cerca del fondo, saldrá una vena liquida con mucha velocidad, aunque no será grande la energía por ser poca la masa, si bien el ímpetu es considerable; si un orificio de gran diámetro se practica á poca distancia del nivel superior, saldrá una gran cantidad de agua y la energía será considerable aunque pequeña la velocidad, saltando la vena liquida á poca distancia de la pared del recipiente.
La vena en el primer caso representa la descarga en la máquina eléctrica, y sus ruidosos efectos son debidos á la altura del nivel ó potencial; en el segundo representa la corriente de la pila dotada de mucha energía, aunque se deslice silenciosamente, por el pequeño desnivel eléctrico.
773. Manantiales de electricidad.—
Los manantiales ó fuentes de electricidad dinámica, son: 1.° Las reacciones químicas (pilas ordinarias y acumuladores). 2.° La inducción magnética (máquinas magnetoeléctricas y dinamoeléctricas, según que el campo sea debido á imanes ó á electroimanes). Estos diversos manantiales se irán estudiando en lugar oportuno.
774. Historia.—

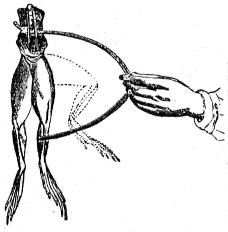
Observó Galvani que poniendo en comunicación metálica los nervios lumbares con los músculos crurales en una anca de rana (fig. 403) muerta recientemente, se producen convulsiones y movimientos análogos á los que ejecuta el animal vivo para saltar. Galvani, que perseguía el descubrimiento de la electricidad animal, atribuyó el hecho á la existencia de electricidades contrarias circulando por los nervios y los músculos del batracio; su organismo, según él, constituye un condensador que se descarga por el arco metálico que pone en comunicación las dos armaduras.
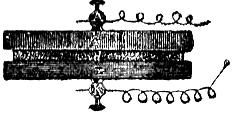
No satisfizo á Volta esta explicación, creyendo que el origen de la electricidad se encontraba en el contacto de los dos metales que debían formar el arco, y esto le indujo á superponer discos de cobre y zinc (figuras 404 y 405), interponiendo entre cada par de discos una roldana de paño mojada con agua acidulada por el ácido sulfúrico; y demostró con esta pila de discos que existia electricidad libre, negativa en el último zinc y positiva en el primer cobre; unidos los cuales con un alambre, por él circulaba la electricidad, sin que desapareciera la tensión de los discos extremos ó polos. Sin entrar en más detalles acerca de esta discusión memorable, sólo debemos advertir que por entonces Fabroni (y aun parece que antes Davy) sostuvo, en contra de la opinión de Volta, que no era el contacto de los metales la causa de la producción de la electricidad en la pila, sino la acción química del agua acidulada, cuyo liquido ha de atacar necesariamente al zinc para que subsista el flujo eléctrico; y en cambio, según Volta, sólo servia para mojar y hacer conductor el paño.

775. Consecuencias. —
Varias consecuencias deben sacarse de la breve reseña ó relato histórico que nos hemos permitido acerca de la invención de la pila: 1.ª La necesidad de la observación y de la experiencia que dan motivo á los genios, por impulso cuasi divino, á realizar progresos inconcebibles. 2.ª Las ventajas de la discusión científica sobre las polémicas de otro género, cuando las razones se apoyan en nuevos experimentos, sirviendo las objeciones del contrario para aguzar el ingenio del que defiende la tesis. 3.ª Que habiendo estado Fabroni más cerca de la verdad para la explicación de la causa de la electricidad dinámica, fue desatendida su opinión por no haber presentado número suflciente de hechos incontrovertibles que la atestiguaran, único medio de vencer en tales lides. 4.ª Finalmente, que en algunos casos pueden ser fecundos y ciertos los principios diversos que se debaten, como sucedió en el actual; puesto que los progresos de la ciencia han demostrado que tenia razón Galvani en afirmar la existencia de la electricidad animal, ya bien comprobada: la tenia Volta, pues los últimos y más delicados experimentos demuestran que se produce una diferencia de potencial por el simple contacto de dos substancias heterogéneas; y asimismo el principio de la conservación de la energia exige que la acción química intervenga para mantener la corriente, que si no se engendraría entonces de la nada, alcanzando asi el triunfo definitivo la opinión sustentada por Fabroni.
776. Pilas.—
Reciben este nombre los aparatos destinados á producir electricidad dinámica por medio de las acciones químicas ó del calor. Denomínase impropiamente par, ó mejor, elemento voltaico, el conjunto de cada dos metales y el ácido ó liquido activo. Polos de una pila son los puntos extremos donde se acumulan las electricidades contrarias; por lo cual se designan con el nombre de positivo ó ánodo y negativo ó cátodo. El paso de la electricidad se efectúa por medio de unos alambres ó hilos conductores llamados reóforos ó electrodos, que reúnen los dos polos. La figura 404 representa un par voltaico, donde c es el disco de cobre, d el paño mojado con agua acidulada, z el zinc, y los electrodos se atornillan en A y K.
El flujo eléctrico ó la corriente se establece al poner en contacto los electrodos, en cuyo caso se dice que queda cerrado el circuito, y al separar los alambres y cesar la corriente, que ésta se halla interrumpida ó abierto el circuito.
Conforme se indica en la misma definición, las pilas y las corrientes que originan se llaman hidroeléctricas, si son debidas á reacciones químicas, generalmente de los ácidos y los metales, y reciben el nombre de termoeléctricas cuando se utiliza en ellas la acción del calor. También se dividen en pilas de corriente constante y variable, con algunas otras denominaciones que se irán estudiando.
777. Pila de Volta.—
So compone de una columna (figura 405) formada por discos superpuestos de cobre y zinc, separando cada par ó elemento voltaico mediante roldanas de paño mojadas en agua acidulada por el ácido sulfúrico (1).
778. Teoría del contacto.—
Según Volta, el contacto de dos metales desarrolla una fuerza electromotriz capaz de mantener separadas las dos electricidades en cada uno de los metales; que tratándose del cobre y del zinc era éste electropositivo, y el cobre el electronegativo. Dicha fuerza electromotriz, ó diferencia de potencial, subsiste cualquiera que sea la electricidad que comuniquemos al par; de manera que si se representa por e y le damos una cierta cantidad de electricidad positiva + a, ésta se distribuirá por los dos metales de modo que al principio tendrá + e y después a + e. Ahora bien: disponiendo un segundo par sobre el primero, las dos fuerzas electromotrices se suman y en general se multiplican con el número de pares iguales. Esta teoría es insuficiente para explicar la corriente continua susceptible de producir movimientos y de convertirse en otras formas de la energía que necesariamente suponen una fuerza que las engendre; pues no basta el simple contacto, sino para determinar un estado eléctrico diferente, ó sea la diferencia de potencial, mas no para desarrollar la electricidad, ó lo que es lo mismo, energía, de un modo indefinido. Esto equivaldría á haber resuelto el problema del movimiento continuo, ó á sacar fuerza de la nada.
779. Teoria química .—
Los experimentos de Volta y otros posteriores, que no dejan lugar á duda acerca de su exactitud, prueban que el contacto de cuerpos cualesquiera determina en general una alteración del equilibrio eléctrico; mas la causa de la continuidad de la corriente debe buscarse en otra energía que puede ser mecánica, como sucede enlazando los polos de una máquina de Holtz, ó calorífica, en las pilas termoeléctricas, ó bien química, y en el caso presente se debe á la acción del ácido sobre el metal, en contra de la creencia de Volta que, según hemos dicho anteriormente, no le asignaba otro papel que el de simple conductor de la electricidad desarrollada por la fuerza electromotriz debida al contacto de los metales.
780. Experimentos.—
Pueden citarse multitud de experimentos, que prueban el desarrollo de la electricidad por las reacciones químicas.
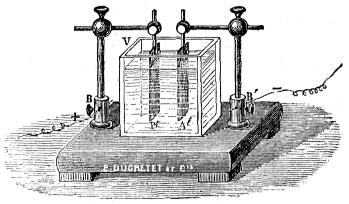
1.° Acido y metal.— Introduciendo dos láminas metálicas que no se toquen Al y Pt (fig. 406) en una cuba de vidrio V que contiene agua acidulada, se observará el paso de una corriente que va por el exterior (2) desde el metal no atacado hacia el que se disuelve en ol ácido; si, por ejemplo, es el ácido nítrico y se introducen en vez de láminas dos alambres de platino, no habrá reacción química, ni corriente eléctrica, hasta echar unas gotas de ácido clorhídrico cerca de uno de los alambres, que será atacado por el agua regia formada.
2.º Metal y óxidos (Hidratos).—
La experiencia se repite con una disolución de potasa cáustica, empleando el cobre y el zinc, que es atacado por ella.
3.° Ácidos y óxidos (Hidratos).—
Se pone el ácido en la cuba y el hidrato potásico dentro de un vaso poroso, introduciendo en los líquidos los reóforos de platino, metal que no es atacado; pero sí hay reacción entre el ácido y la potasa para formarse la sal correspondiente.
781. Explicación de la corriente.—
Los experimentos que preceden demuestran, según el dicho de Faraday, que la corriente es una acción química en movimiento; es decir, que se produce mientras subsiste la reacción química, cesando cuando ésta termina, y por lo tanto la corriente lleva consigo toda la energía que es susceptible de desplegar aquélla, en cualquier punto del hilo conductor por donde circula.
Ahora bien, en la hipótesis de dos electricidades, éstas se acumulan en los dos polos, que simbólicamente representaremos por (+ A) y (— B) (fig. 407) y el conductor intermedio por las trazas m, n,... etc. Las electricidades se acumularían, según se indica, viniendo la positiva de la molécula próxima al polo negativo (— B) á neutralizar la del mismo, así como la negativa del extremo opuesto se dirige hacia el polo positivo (+ A). En el momento en que esto se verifica hay neutralización de las electricidades entre cada dos moléculas sucesivas, conforme indican las llaves, y volvería á reproducirse una nueva polarización eléctrica, que da en último resultado origen á dos corrientes, una de electricidad negativa dirigida al polo positivo, y otra contraria hacia el polo negativo.

Esta explicación la reproduciremos al hablar de la electrólisis ó descomposición mediante la pila: presenta, no obstante, la dificultad de que en muchos fenómenos la corriente parece dirigirse por el conductor exterior solamente del polo positivo al negativo.
Admitiendo el éter ó un fluido eléctrico, la corriente sería un verdadero flujo de electricidad que se precipita con velocidad prodigiosa del polo positivo al negativo.
De lo dicho resulta que en la pila de Volta la gran cantidad do electricidad que recorre el circuito se debe á la producción del sulfato de zinc por la reacción que podemos formular
SO4H2 + Zn" = SO4Zn" + H2 [1]782. Pila de columna.—
Conforme dejamos expuesto, la primitiva pila (fig. 405) tenía los discos formando columna; mas esta disposición presenta graves inconvenientes: 1.º Determina la expresión de las roldanas de paño, que se desecan pronto, y faltando ácido no puede continuar la reacción química productora de la corriente. 2.° Al fluir el líquido por el exterior de la columna establece comunicación entre los pares, lo cual debilita la tensión ó disminuye la diferencia de potencial en los polos. 3.° Se produce en esta pila y en todas las modificaciones que de ella se han hecho, la polarización de los electrodos, ó sea la acumulación del hidrógeno sobre los discos de cobre, perdiendo, por lo tanto, la conductibilidad eléctrica.
Si á esto se añade la dificultad de montar y desmontar la pila, se comprenderá desde luego que fue necesario darle otra disposición más apropiada para utilizarla en los gabinetes y laboratorios.
783. Modificaciones.—
La pila de artesa es una caja prismática de madera, con tabiques formados de láminas de cobre y zinc soldadas, dejando intervalos donde se pone el agua acidulada. Tiene la ventaja de poder añadir el ácido cuando se gasta; pero es difícil de limpiar y se polariza mucho.
Pila de corona.— Los elementos de esta pila son también tiras de cobre y zinc, redobladas convenientemente para sumergirlas en vasos de vidrio donde se pone el agua acidulada.
Pila de Wollaston.— Cada par de esta pila está construido con una plancha gruesa de zinc, rodeada por ambas caras de una lámina de cobre separada del zinc por travesaños de madera.
De todas estas pilas la única que aún se usa alguna vez es la de Wollaston, por la poca resistencia interior que ofrece y por prestarse fácilmente al estudio de los efectos de cantidad, como son los del calor producido por la corriente; y se citan solamente para mostrar los progresos sucesivos del descubrimiento de Volta, que ha hecho época en el estudio de la Electricidad.
CAPITULO LXIV
Diversas pilas eléctricas.
784. Pilas de corriente constante.—
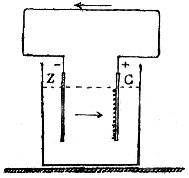
Dejamos dicho (782) que la principal causa del debilitamiento de la corriente depende del consumo del ácido, y sobro todo de la polarización ó depósito de hidrógeno sobre el cobre. Á primera vista parece contradictorio que el hidrógeno, que en la parte exterior del circuito se dirige hacia el polo negativo, ó sea el zinc, vaya á depositarse por el interior de la pila sobre el polo positivo; pero esta dificultad se desvanece por la simple consideración de que toda pila funciona precisamente cuando se cierra el circuito, y si la corriente en el exterior va del polo positivo al negativo, y en este sentido es arrastrado el hidrógeno resultante de la descomposición del agua, por dentro de la pila la corriente ha de dirigirse del zinc al cobre, según indican las flechas (fig. 408) para formar un circuito completo.
Cuando se trata de obtener efectos constantes es indispensable evitar el depósito de hidrógeno sobre el polo positivo, conforme se propuso Becquerel y otros físicos distinguidos, valiéndose en general de elementos formados con dos líquidos, uno despolarizante, en donde se sumerge el polo positivo, y destinado el otro á producir la reacción química como de ordinario, estando separados los líquidos por un tabique poroso.
785. Pila de Daniell. —
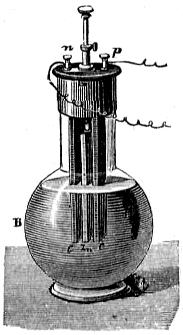
Es una pila de corriente constante, cuya fuerza electromotriz vale 1,02 voltios: los elementos están constituidos por el cobre y el zinc, y los líquidos, separados por un vaso poroso, son el agua acidulada con el ácido sulfúrico, en donde se sumerge el zinc y la disolución de sulfato de cobre que obra como despolarizante bañando la lámina de cobre.

El primero actua sobre el zinc para formar sulfato de este metal, produciendo la electricidad á causa de la misma reacción que en las pilas anteriores (781); pero el hidrógeno que se dirige al cobre encuentra antes al sulfato cúprico, dejando en libertad el metal, á quien sustituye, y regenera así el ácido sulfúrico: atravesando éste el vaso poroso continúa la reacción sin empobrecimiento del agua acidulada. Simbólicamente puede formularse esta sustitución del modo siguiente:
SO4Cu" = SO4H4 + Cu" [2]Resulta, pues, que ni hay polarización, porque se depositan sobre la lámina de cobre cristales del mismo metal, ni disminuye sensiblemente el ácido sulfúrico de la disolución; lo cual hace que esta pila funcione durante mucho tiempo sin otro cuidado que añadir cristales de sulfato cúprico, ó agua á medida que se evapora. Por su constancia se usa la pila de Daniell, más ó menos modificada, de preferencia en las lineas telegráficas.
La figura 409 representa un elemento primitivo de Daniell con el cilindro de cobre agujereado C, que lleva en la parte superior un reborde anular, donde se ponen los cristales de sulfato cúprico para mantener saturada la disolución.
780. Modificaciones.-
Con el fin de disminuir la resistencia interior de esta pila y la molestia que ocasionan los vasos porosos, se han suprimido en las pilas de Minotto y de Callaud (fig. 410), en las cuales el cobre, ya sea una lámina, ó una simple espiral como representa el grabado, ocupa el fondo del vaso entre cristales de sulfato cúprico, á fin de que el liquido esté saturado.

Un grueso alambre se suelda á la lámina, recubriéndole de un tubo aislador que impide el contacto con el agua ligeramente acidulada de la mitad superior, hasta donde llega la lámina de zinc encorvada en forma de cilindro. Distinguese la pila de Minotto de la de Callaud en llevar la primera una capa de arena sobre los cristales de sulfato, á fin de que la separación de las dos porciones del líquido sea más completa que por la simple diferencia de densidades, lo cual dificulta en cambio montarla y desmontarla cuando es necesario para la limpieza.
787. Pila de Bunsen.—
El elemento de estas pilas está constituido por zinc y carbón, agua acidulada y el líquido despolarizador, que es el ácido nítrico comercial. Además de producirse en la pila de Bunsen la reacción conocida [1] (781) origen de la corriente, se evita el depósito de hidrógeno sobre el carbón, porque al encontrar aquél al ácido nítrico se combina con parte de su oxigeno, formando agua con desprendimiento de vapores nitrosos, según indica la fórmula
2NO3H + H2 = 2H2O + 2NO2 [3]

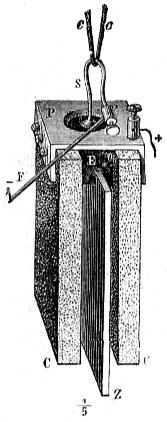
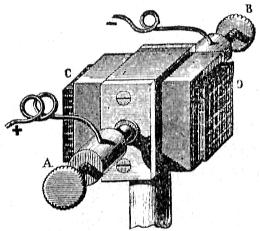
Dispónese en cada elemento (fig. 411), primero el tarro de porcelana ó de vidrio que contiene el agua acidulada en donde se sumerge la lámina de zinc encorvada en cilindro: dentro de éste se halla luego el vaso poroso con el ácido nítrico que baña el prisma de carbón. Los elementos, que tienen 1,8 voltios de fuerza electromotriz se unen entre si por láminas de cobre, según indica el grabado, que representa una pila de diez pares cargada en tensión; es decir, unido cada carbón con el zinc del par siguiente, empleando para sujetar las tiras de enlace unas piezas de bronce, ó pinzas de tornillo, n, m.
788. Pila de Grove.-
Puede referirse á la anterior la pila de Grove, difiriendo únicamente ésta, que fue inventada primero, por llevar una lámina de platino en vez del carbón, lo cual la hacía más costosa y no se hubiera generalizado tanto como la de Bunsen, que es preferible á todas por presentar en igualdad do elementos una corriente más enérgica, si bien de menor constancia que la de Daniell.
789. Pilas diversas.—
Uno de los más graves inconvenientes que ofrece la pila de Bunsen para el uso de los laboratorios y talleres, estriba en lo enojoso de montarla y desmontarla, así como en el desprendimiento de vapores corrosivos cuando funciona por algún tiempo: de aquí el considerable número de reacciones que se han propuesto para construir otras tantas pilas, cuya descripción puede llenar gruesos volúmenes. Las más generalizadas son:
1.ª La pila de sulfato de mercurio (fig. 412), cuya sal sustituye al ácido nítrico dentro del vaso poroso, teniendo, como la de Bunsen, el polo positivo en el carbón y el negativo en el zinc. La reacción en estas pilas se reduce á la sustitución por el zinc, del mercurio de la sal: éste queda libre, formándose sulfato de zinc.
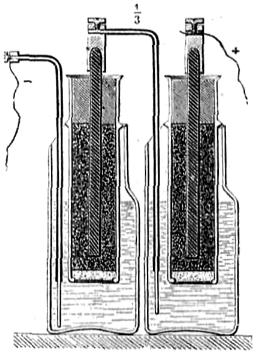
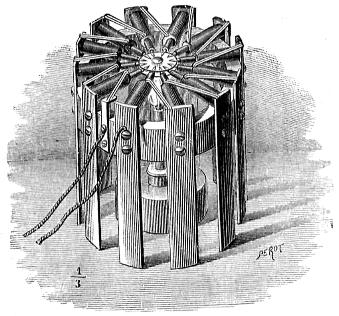
2.ª Pila de bicromato potásico.— Se dispone ordinariamente un par (fig. 413), con una lámina de zinc Z puesta entre dos de carbón C, C' sujetas á una misma plancha P, que á veces es un disco de ebonita y sirve de tapa á los vasos, como se indica en el elemento de la pila de Grenet (fig. 414), y se sumergen en la disolución acuosa del bicromato, añadiendo ácido sulfúrico. Esta pila, aunque de un solo liquido, es bastante enérgica, produce 2 voltios de f. e. m. y tarda en polarizarse. Con el objeto de que no se gaste el zinc sino cuando haya de funcionar la pila, en unos modelos se levantan los pares F (fig. 415), según puede verse por la simple inspección del grabado, mediante las cuerdas c, que se arrollan en el torno A, y en otros, como el representado en la figura 414, pueden elevarse las láminas de zinc mediante las varillas verticales á que están soldadas, que se sujetan luego con un tornillo de presión. El desprendimiento de la electricidad se debe á una acción química muy compleja, produciéndose sulfatos de zinc, crómico y potásico, con formación de agua, resultante de la combinación del hidrógeno con el oxígeno cedido por el ácido crómico, que es el despolarizador de estos elementos.
Algunos constructores introducen el zinc en el agua acidulada que está en un vaso poroso, rodeando éste de carbones, dentro de la disolución de bicromato sódico, en vez de potásico, con lo cual parece que se obtienen grandes ventajas.
3.ª Pila de Leclanché.— El metal atacable en la pila de Leclanché es también el zinc; pero el líquido que reacciona es una disolución de cloruro amónico contenida en un vaso de vidrio (fig. 416), donde se sumergen una barrita cilindrica de zinc y el vaso poroso, lleno de peróxido de manganeso mezclado con carbón de retorta, que forma el polo positivo. Como en esta pila no se pone ácido varian las dos reacciones, 1.ª sobre el zinc, y 2.ª la despolarizadora, que son:
1.ª 2ClNH4 + Zn" = Cl2Zn" + 2NH3 + H2 .
2.ª H2 + 2MnO2 = Mn2O3 + H2O.

En rigor, resulta oxicloruro de zinc y un cloruro doble de amonio y de aquel metal (3): aunque bastan las fórmulas escritas para tener una idea de la acción química, origen de la corriente cuya f. e. m. es de 1,02 voltios.

La pila de Maiche es una modificación de la anterior, que ofrece ventajas por su constancia y mayor duración, pero con el inconveniente de la fragilidad y más alto precio. El liquido activo es la misma disolución de sal amoniaco, y el polo negativo la amalgama de zinc con un exceso de mercurio, puesto en una cápsula de porcelana, sostenida en la parte inferior por un cilindro de ebonita que aisla el alambre de platino hundido por un extremo en el mercurio, y en el otro se halla el botón donde se fija el electrodo. El conductor no atacable es sólo carbón platinado, sin manganesa, contenido dentro de un vaso poroso que está agujereado y ocupa la parte superior de la disolución. El hidrógeno se desprende sin adherirse al carbón platinado.
790. Pila de sal. —
No terminaremos este punto sin citar la pila de sal común, cuya disolución reemplaza la de sal amoníaco usada en las anteriores, produciéndose una reacción no bien estudiada sobre el zinc y desprendiéndose el hidrógeno en el polo positivo, que es el carbón. Esta pila es muy usada en Suiza para los timbres eléctricos y en la telegrafía, mereciendo fijar la atención de los físicos é industriales españoles con el fin de utizar la sal común ó directamente el agua del mar en nuestros numerosos puertos para la producción de la corriente eléctrica; pues hasta el presente han sido infructuosas las tentativas hechas con tan plausible objeto.
791. Pilas secas. —
Se han construido pilas de poca intensidad, pero que funcionan durante mucho tiempo sin más liquido que la humedad del aire. La pila de Zamboni está formada por discos de papel, que llevan pegada una hoja de estaño en una de sus caras y en la otra una capa de manganesa. Doblado el papel convenientemente, se recortan de una vez varios discos con un sacabocados, y superpuestos con orden como en la pila de columna y atados fuertemente, el disco de cobre en contacto con el bióxido de manganeso será el polo positivo; el que descansa sobre el estaño, el negativo, metal atacado por el oxigeno del bióxido.
Aun cuando no tengan ya importancia estas pilas, convenía citarlas, porque se construyen juguetes y algún aparato fundado en la constante atracción de sus polos.
792. Zinc amalgamado. —
El zinc puro y el ordinario cuando está amalgamado en la superficie, presentan la ventaja sobre el zinc del comercio, de no ser atacados por el ácido hasta que se cierra el circuito; por cuyo motivo es una operación previa, indispensable, amalgamar los zines, frotándolos simplemente con mercurio, si queremos conservarlos en buen estado. Cuando no se toma esta precaución, el zinc impuro se corroe al poco tiempo, explicándose que continúe la acción química, á pesar de hallarse abierto el circuito, porque se establecen corrientes parciales entre el zinc y el plomo ú otros cuerpos que generalmente impurifican la lámina metálica.
793. Formación de las pilas. —
Después de haber descrito diversas clases de elementos de pilas hidroeléctricas, conviene fijar algunas reglas que deben tenerse presentes para agruparlos formando pilas:
1.ª Los pares que se enlacen han de ser todos de igual clase y á ser posible del mismo tamaño.
2.ª Cuando deseamos producir mayores efectos de tensión ó de potencial, se enlazan los pares en serie; es decir, cada zinc de un elemento con el cobre ó carbón del par inmediato, como sucede en la pila de columna y en otros casos anteriormente citados (figs. 410 y 411).
3.ª Para obtener mayores efectos caloríficos, con potencial más débil, se agrupan los pares en cantidad; ó bien todos los electrodos positivos de un lado y todos los negativos entre si.
4.ª Si es necesario producir efectos mixtos, se adopta una combinación también mixta, formando varias pilas en serie, cuyos electrodos positivos de los elementos extremos se enlazan entre si é igualmente todos los negativos. Más adelante expondremos las razones teóricas confirmadas en la práctica en que se funda la disposición más adecuada que en cada caso deba darse á los pares.
CAPITULO LXV
Pilas termoeléctricas.
794. Experimentos de Seebeck. —
Supongamos un alambre por donde circula la electricidad de una pila, cuyo polo positivo está en A (fig. 417) y el negativo en B: la corriente llevará la dirección de la flecha; y una aguja imanada paralela al alambre antes de cerrar el circuito, se sitúa perpendicularmente á la posición de equilibrio asi que pasa la corriente. El efecto es más sensible con la doble aguja de polos opuestos, llamada semiastática, que se dibuja aparte y puede sustituir á la sencilla que lleva el pie vertical.
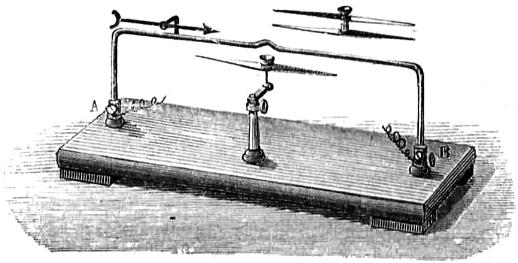
Seebeck formó un circuito análogo con dos láminas, una de bismuto y otra de antimonio, soldadas por sus extremos; habiendo observado que si se calienta con la llama una de las soldaduras, la aguja semiastática se desvia como antes, indicando el paso de una corriente producida por la simple acción del calor sin necesidad de pila hidroeléctrica.
795. Par termoeléctrico. —
Las corrientes termoeléctricas asi engendradas por la transformación de la energía calorífica en electricidad, no difieren esencialmente de las hidroeléctricas debidas á la acción química, y podemos considerar ahora, como antes (776), pares ó elementos termoeléctricos, formados únicamente por dos metales soldados por sus extremos para cerrar un circuito, los cuales se enlazan asimismo convenientemente para constituir pilas.
796. Leyes. —
Debe advertirse que la fuerza electromotriz propia de un par termoeléctrico, es una fracción muy pequeña de la correspondiente á un elemento de Daniell, que aproximadamente representa la unidad ó, como ahora se dice, un volt ó voltio, variando la intensidad de la corriente (4) en un circuito determinado, según las circunstancias ó leyes siguientes:
Primera. En un mismo par termoeléctrico la intensidad es proporcional á la diferencia de temperatura de las soldaduras, hasta cierto limite variable con los metales que constituyen el par: para el cobre y bismuto, esta diferencia es de 45°; para el hierro y cobre es de 300º. Elevando mucho la temperatura, disminuye, se anula y puede invertirse el sentido de la corriente.
Segunda. En una pila de pares idénticos, por su naturaleza, superficie y diferencia de temperatura, la intensidad es proporcional al número de pares.
Tercera. La intensidad y el sentido de la corriente dependen de la naturaleza de los metales, en igualdad de las demás condiciones. Luego veremos (797) han formado listas que contienen los diferentes metales, desde el más electropositivo, que es el antimonio, al bismuto, el más electronegativo; pero difieren los resultados obtenidos por eminentes físicos á causa de la gran influencia que ejercen pequeñas cantidades de otros cuerpos que los impurifiquen. Según Becquerel, para producir una corriente de la misma intensidad que un elemento Daniell, se necesitan 29 pares formados por sulfuro de cobre y metal blanco, 188 de antimonio y bismuto, 1.053 de hierro y cobre con una diferencia media de 100° entre las soldaduras de lugar par é impar.
Respecto á la manera de operarse la transformación de la energía calorífica en eléctrica, se han propuesto varias hipótesis y ejecutado algunos experimentos con el fin de determinar previamente datos seguros en que apoyarlas, fijando la atención de los físicos de un modo especial la influencia que ejerce la conductibilidad de los metales que constituyen el par; mas únicamente debemos citar acerca de este asunto dos resultados, fáciles de comprobar en las clases elementales:
1.° Basta alterar la estructura de un alambre en un punto, retorciéndolo, formando un nudo ó arrollándole en tirabuzón, para que calentando á la derecha, v. gr., de este punto se produzca una corriente termoeléctrica, que cambia de signo si aplicamos la llama al otro lado.
2.° Hay producción de una corriente termoeléctrica por el contacto de una tira de cobre calentada en una disolución de sulfato cúprico, ó en otra que no ejerza reacción química, pues se desvía la aguja del galvanómetro puesto en relación con las tiras mediante el aparato descrito (780).
797. Serie termoeléctrica. —
En virtud de lo expuesto ha sido posible formar una lista de los metales, de modo que cada uno de ellos desarrolla una fuerza electromotriz positiva con el que le precede, y negativa con el que le sigue, la cual constituye la serie termoeléctrica. He aquí algunos de los metales que la constituyen.
Bismuto, níquel, platino, plata, estaño, plomo, cobre, oro, zinc, hierro, antimonio.
Dicha fuerza electromotriz es, por consiguiente, tanto mayor cuanto más separados se hallan los metales en la serie; de modo que entre los citados alcanza su máximo valor en el par bismuto y antimonio; pero habiendo observado Becquerel que el azufre, al combinarse con los metales, modifica sus propiedades termoeléctricas, pudo hallar con la pirita de cobre (sulfuro doble de cobre y de hierro) y el protosulfuro de cobre, un par termoeléctrico, que en igualdad do condiciones produce una intensidad de corriente que supera al par bismuto antimonio.
798. Disposición que se da á estas pilas. —
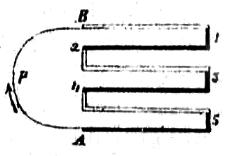
Una de las aplicaciones principales de las pilas termoeléctricas, y á la cual hemos hecho referencia en varias ocasiones (592), ha sido la de Nobili, que forma parte del termomultiplicador de Melloni, disponiéndose las barritas planas de bismuto y antimonio, según indican las figuras 418 y 419. La última representa una sección en que las rayas negras A corresponden al antimonio y las B al bismuto, quedando los soldaduras impares á un lado D y las pares al opuesto C, de modo que si se calientan las primeras la corriente marcha, según indica la flecha, de A, polo positivo, hacia B, polo negativo.
799. Pila de Noé. —
Queriendo utilizar ol fuego, indispensable á veces para el caldeo de las habitaciones, en la producción de corrientes, que fuera de desear lleguen á emplearse en el alumbrado, etc., se disponen pilas termoeléctricas como la de Noé (fig. 420) formada por elementos de metal blanco y una aleación de antimonio, de modo que las soldaduras pares concurran en un punto donde actúa la llama y en las impares se apliquen láminas delgadas de cobre que presentan hacia el exterior una gran superficie irradiante para facilitar el enfriamiento. Otra pila bastante usada es la de Clamond, constituida con elementos de hierro y una aleación de antimonio y zinc.
800. Aplicaciones. —
Las pilas de Noé y Clamond pueden utilizarse por su constancia en la galvanoplastia, aunque resultan costosas por el mucho gasto de combustible y por su rápido deterioro.
Se emplean principalmente las pilas termoeléctricas para la medida de temperaturas, habiéndose citado en varias ocasiones con este objeto el termomultiplicador, y también se utilizan como pirómetros para las muy elevadas, elementos formados con metales poco fusibles, como el platino y el paladio ó el rodio, y asimismo se usan cuando se han de apreciar las temperaturas muy bajas de los gases liquidados (par cobre argentan). En todos los casos basta tener una soldadura en el punto cuya temperatura se quiera apreciar (el horno, el cuerpo humano, el suelo, etc.), y la otra á una temperatura constante, que suele ser de 0º.
(1) Esta disolución se obtiene mezclando nueve partes de agua por una de ácido sulfúrico del comercio.
(2) Los electrodos B y B' se ponen en comunicación con un galvanómetro.
(3) El oxicloruro de zinc se deposita por todas partes y, de consiguiente, en el interior sobre el carbón y la manganesa, contribuyendo á la rápida polarización de estas pilas, cuyos vasos porosos pueden continuar sirviendo sin desmontarlos, con sólo verter clorhídrico por un agujero abierto en la capa de pez, que se tapa después de limpio el electrodo positivo.
(4) La intensidad de una corriente es la cantidad de electricidad que pasa por un circuito dado en la unidad de tiempo.
"Elementos de Física" Eduardo Lozano y Ponce de León
Catedrático por oposición de la referida asignatura, actualmente numerario de acústica y óptica en la Universidad Central, doctor en ciencias físico-matemáticas, graduado en la sección de físico-químicas y licenciado en farmacia, miembro de la Real Academia de Ciencias y Artes de Barcelona, oficial de la instrucción pública en Francia, corresponsal de la Económica matritense y de otras sociedades.
Aprobada por el Consejo de Instrucción Pública, y destinada para servir de texto en los Institutos de 2ª enseñanza y Escuelas de Artes é Industrias.
Novena edición corregida y revisada por el ingeniero D. Eduardo Lozano y Monreal
Establecimiento tipográfico de Jaime Ratés, Madrid, 1907