
Nitrógeno
La presencia de nitrógeno biosférico es pequeña pero muy importante. Este elemento forma parte de los nucleótidos del ADN y del ARN, que almacenan y transfieren la información genética necesaria para la construcción de las proteinas, unas moléculas complejas compuestas de aminoácidos, que además de su función estructural intervienen como emisoras, receptoras, marcadoras, defensoras y elementos catalíticos en los procesos de la vida. Como no podemos sintetizar los aminoácidos esenciales, tenemos que consumirlos en forma de proteínas en la alimentación. Por tanto, un aporte adecuado de nitrógeno en los cultivos que suministran directamente, a través de alimentos vegetales, e indirectamente como carne, huevos y productos lácteos, la mayor parte de la energía para nuestro metabolismo es un requisito clave para la existencia y desarrollo heterótrofo.

Se entiende la preocupación referida a la adecuación de la cantidad de nitrógeno disponible si sabemos del papel fundamental que tiene éste en la producción de alimentos y su escasez y movilidad en la biosfera. Ya en 1900, los agrónomos y los químicos eran conscientes de la barrera amenazadora que suponía la limitada disponibilidad de nitrógeno para aumentar el rendimiento de las cosechas. Reciclar intensivamente materia orgánica podría aumentar la productividad de las cosechas, pero no hay suficiente materia orgánica reciclable para suministrar las cantidades de nitrógeno necesarias para aumentar el cultivo a gran escala. El nitrógeno inorgánico de los nitratos de Chile (NaNO3) y del guano, orgánico en este caso, de las islas Chincha podría resolver esta escasez, pero sólo temporalmente. Otras posibilidades, como la síntesis de cianamida (CaCN2), descubierta en Alemania en 1898, y la formación de óxidos de nitrógeno en una descarga eléctrica, que se consiguió realizar en Noruega en 1903, requerían demasiada energía para su aplicación masiva.
El avance fundamental se produjo cuando Fritz Haber descubrió el procedimiento para sisntetizar el amoníaco a partir de sus elementos constituyentes utilizando altas temperaturas, alta presión y osmio y uranio como catalizadores. Carl Bosch, en la compañía BASF, hizo posible la reacción de Haber mediante un proceso industrial, completándose la primera fábrica de amoníaco en Oppau, cerca de Ludwigshafen am Rhein, en 1913. En tiempos de guerra, en vez de producir fertilizantes, suministraba ácido nítrico a Alemania para la fabricación de explosivos. La crisis mundial de los años treinta y la Segunda Guerra Mundial pospusieron hasta los primeros años cincuenta el despegue de la fabricación a gran escala de fertilizantes. Entre 1950 y 1995 la producción mundial de abonos de amoníaco pasó de menos de 5 millones de toneladas a cerca de 80 millones, y la proporción que este tipo de abono representa en el total de los abonos usados ha pasado de más de nueve quintas partes en los países ricos a tres quintas partes en los países en vías de desarrollo.
Los fundamentos del proceso Haber-Bosch no han cambiado, pero su eficiencia ha crecido sustancialmente. Los avances más importantes se produjeron en los años sesenta, cuando se cambiaron los compresores alternativos por compresores rotatorios, que permitieron, además de un ahorro de electricidad de hasta el 95 por ciento, la construcción de fábricas más grandes y más económicas. Otras mejoras importantes fueron la sustitución del carbón por gas natural, no sólo como combustible sino también como fuente de hidrógeno, lo cual redujo el coste energético, y la utilización de catalizadores especiales que mejoraron el rendimiento de la reacción. En 1990, el consumo energético para producir industrialmente amoníaco era inferior a 35 Mj/Kg de N, que es menos de la quinta parte del consumo de la primera síntesis comercial a principios de los años veinte. La compañía M. W. Kellogg de Houston es el mayor fabricante del mundo: en 1995 tenía 150 grandes plantas productoras en funcionamiento o en construcción.
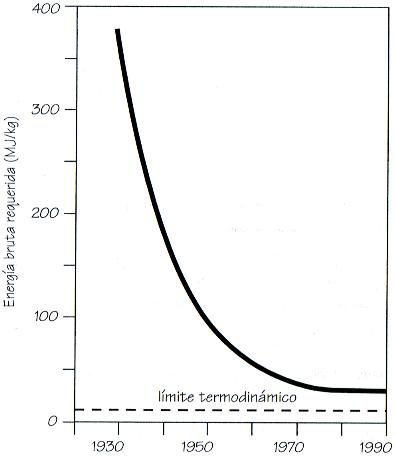
El amoníaco presenta algunos inconvenientes: a presión normal es un gas y, por tanto, se requieren cuidados especiales para su transporte y utilización. Ésta es la razón por la que la urea, que es un compuesto sólido con un alto contenido de nitrógeno, se haya convertido en el fertilizante más utilizado. La urea en grano se aplica con gran facilidad, tanto a mano en cultivos de poca extensión, como en las explotaciones grandes y avanzadas donde la tierra se abona mediante maquinaria especial controlada por ordenador. La síntesis de la urea y de otros fertilizantes nitrogenados es energéticamente más costosa. Dependiendo del proceso y de la antigüedad de la fábrica, la producción de urea cuesta entre 70 y 110 MJ por cada kilogramo de nitrógeno (MJ/Kg N) y la de NH4NO3 entre 60 y 100 MJ/kg N. A pesar de ello, se puede considerar que la producción de abonos nitrogenados sintéticos es muy barata porque, tomando como coste medio 70 MJ/Kg N, la producción total de abonos representa menos del 2 por ciento del consumo energético mundial.
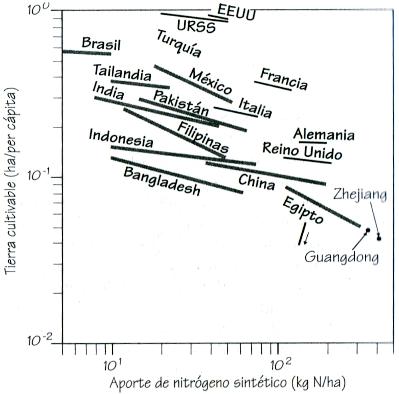
Esta es una cantidad muy pequeña considerando la enorme importancia de los nutrientes. Medidas cuidadosas han permitido estimar que, a mediados de los años noventa, la cantidad de nitrógeno consumida como abono en la agricultura mundial fue de 175 (los valores extremos son 140 y 210) millones de toneladas. De esa cantidad, dos quintas partes corresponden a compuestos sintéticos y en la cosecha se retira aproximadamente la mitad del nitrógeno total aportado. Pero como la eficiencia del abono está comprendida entre el 45 y el 55 por ciento, resulta que aproximadamente la mitad de todo el nitrógeno de las cosechas es suministrado por amoníaco sintético. Por otro lado, como las tres cuartas partes del nitrógeno que se metaboliza en las proteínas procede de las cosechas, el resto viene de los océanos y pastos silvestres, las proteínas de la dieta de al menos uno de cada tres, y quizá dos de cada cinco, habitantes del planeta proceden de abonos nitrogenados sintéticos.
"Energías" Vaclav Smil
Editorial Crítica S.L., Barcelona, 2001