Fig. 245.
Combustibles
496. Condiciones de los combustibles.
Muchos son los cuerpos que pueden llamarse combustibles, puesto que son muchos los que al combinarse con el oxígeno desprenden calor y aun luz; pero tratándose de utilizar este calor producido, quedan reducidos á muy pocos. Las condiciones que debe tener un cuerpo para poder ser útil como combustible son: que arda fácilmente en el aire, produciendo por el acto de su combustion un calor suficiente para seguir ardiendo; que sea abundante ó de bajo precio; y que los productos de la combustion no dañen, ni á los cuerpos que han de recibir su calor, ni á los animales ó vejetales que han de estar bajo su influencia. Estas condiciones las llenan solo los cuerpos en que el carbono y el hidrógeno forman la parte principal, y son los siguientes: maderas, carbon de madera, carbon de piedra ó hulla, carbon de hulla ó cok, antracita, lignito, turba, carbon de turba, y algunos otros, corno casca de tenería y estiércol, pero de poca importancia. Ocupémonos primero de los combustibles en general, y después los examinaremos en particular.
497. Combustibles en general.
El calor de un combustible se disipa por dos causas; la una es por el que abandona al aire que alimenta su combustion y á los gases que de ella se desprenden; la otra es por la radiacion. Conocida la cantidad total de calor que un cuerpo produce, si se sabe el calor que radia fácil será conocer el calor que pasa al aire, y více-versa.
498. Potencia calorífica de los combustibles. Método de Rumfort.
El problema mas importante que hay que resolver tratándose de un combustible, es el de averiguar la cantidad de unidades de calor que produce un peso determinado de él, ó sea su potencia calorífica. Por varios métodos se ha tratado de resolver este problema, pero todos dejan bastante que desear; empecemos por esplicar el método de Rumfort, modificado en algunos de sus detalles, que es el que ofrece mas exactitud, y no es mas que el método de las mezclas que hemos esplicado detenidamente al determinar el calórico específico de los cuerpos (401).

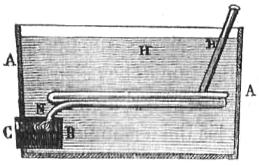
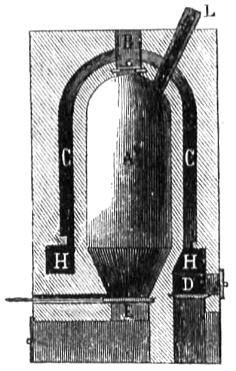
Supongamos una caja metálica A (fig. 245) de bastante capacidad, y en ella otra B cerrada escepto por una de sus caras C, donde tiene una puertecilla; de la parte superior N de esta caja sale un tubo H con varias vueltas, y que tiene el estremo fuera de la caja A. Introduzcamos una cantidad del combustible que queramos examinar, pesada exactamente, en la caja C, y hagamos que arda completamente, habiendo antes echado en la caja A una cantidad de agua cuyo peso conoceremos con exactitud; el calor que produzca el combustible pasará al agua, el radiado, por las paredes de la caja N y el que lleva el aire, por enfriarse en el tubo H antes de salir al esterior: cuando todo el combustible se ha quemado observaremos por medio de un termómetro la temperatura que ha tomado el agua; aunque el cálculo es el mismo que en el método de las mezclas, que antes hemos indicado, vamos sin embargo á repetirle aplicado á este caso particular por su importancia. Supongamos que la temperatura que ha ganado el agua sea 4 grados y el peso de ella 15 kil.: habrán pasado al agua 15 x 4 = 60 calorías (360); pero la caja tambien ha tomado calor que hay que añadir: suponiéndola de hierro, y que su peso con la segunda caja B y el tubo H sea lk,5, como la capacidad calorífica (405) del hierro es 0,11379, el calórico que ha tomado la caja, suponiéndola á los mismos 4 grados del agua, es 1,5 x 0,11379 x 4 = 6,827 calorías, que añadidas á las del agua dan 60 + 6,827 = 66,827 calorías producidas por el combustible empleado. Si suponemos que esta era 12 gramos, tendremos que si 12 gramos dan 66,827 calorías; 1.000 gramos, que es 1 kil., darán 12 : 66,827 : : 1.000 : x = 5.569 próximamente; es decir, que 1 kil. del combustible, empleado produce 5.569 calorías, ó que este número es su potencia calorífica. Las causas de error en este método son, la pérdida de calor del agua por el contacto del aire, la pérdida de la caja pequeña en contacto por delante con el aire, y el calor que llevan los restos de la combustión al salir del tubo H. Para disminuirlas en lo posible procuraremos que el calor del agua sea poco mayor al fin de la operación que el del aire esterior, aumentando la cantidad de ella, y así habrá menos pérdida; y haciendo un ensayo previo pondremos el agua de la caja á una temperatura de la mitad de grados menor que los que se ha de calentar (401): haciendo tambien que el agua sea mucha y el tubo H largo, podremos lograr que el aire que por él sale haya perdido todo su calor, es decir, que salga a la temperatura del aire esterior, que será la que tenia cuando entró en la caja del combustible.
499. Potencia calorífica determinada por el carbono é hidrógeno.
Si se conoce la cantidad de carbono é hidrógeno que contiene un combustible, que son los dos elementos que han de producir la combustion, podremos deducir la potencia calorífica sabiendo la de estos dos cuerpos. En efecto, según resulta de muchas observaciones sobre la potencia calorífica de los cuerpos y tambien de cálculos hechos con toda la posible exactitud, puede admitirse para los combustibles comunes que la cantidad de calor que producen los compuestos de los dos elementos carbono é hidrógeno es igual a la suma de la que producen estos dos cuerpos; pero se ha de tener presente que parte del hidrógeno se combina con el oxígeno que pueda tener el combustible, y forma agua, y esta parte se supone que no produce calor, por lo que hay que quitarla del hidrógeno que se haya encontrado en el cuerpo: por ejemplo, una antracita de la isla de Cuba ha dado en 100 partes de peso la composicion siguiente.
Carbono.......................... 75,85Para calcular la potencia calorífica de esta antracita, veremos qué cantidad de hidrógeno tomará el oxígeno que contiene para formar agua; suponiendo que 12,96 es todo oxígeno porque no sabemos qué parte sea la de azoe, esta cantidad la encontraremos sabiendo la composicion del agua en peso (157), y tendremos que si para 88,89 de oxígeno se necesitan 11,11 de hidrógeno, para 12,96 de oxígeno se necesitarán 88,89 : 11,11 : : 12,96 : x = 1,62, esta cantidad será el hidrógeno que toman las 12,96 de oxígeno, luego restando de las 7,25 partes que contenia el combustible, quedan 7,25 — 1,62 = 5,63 de hidrógeno libre, número que será un poco pequeño por haber contado como oxígeno el azoe, pero que debemos tomar, pues en estas apreciaciones es preferible disminuir los resultados para no engañarnos en la práctica: se ha encontrado por medio del cálculo hecho con la posible exactitud y por esperimentos, que se puede tomar como potencia calorífica del hidrógeno 34.742 calorías por kil., y de aquí resultará que si 100 partes de hidrógeno, que supondremos lk, darían 34.742 calorías, las 5,63 partes ó 0k,0563 nos darán 100 : 34.742 : : 563 : x = 1.956. Tomando para el carbono 7,200 unidades como potencia calorífica, tendríamos por la misma razón 100 : 7.200 : : 75,85 : x = 5.461, despreciando fracciones; sumando estas dos cantidades de calor tendremos 5.461 + 1.956 = 7.417 calorías para potencia calorífica de la antracita en cuestion.
Hidrógeno...................... . 7,25
Oxígeno y azoe................. 12,96
Cenizas........................... 3,94
100,00
500. Por la reduccion del óxido de plomo.
Para ensayar un combustible y deducir su potencia calorífica, se puede emplear otro método que, aunque no exacto, nos dará sin embargo idea de la cantidad de carbon que contiene. Está reducido este ensayo á colocar en un crisol una porcion de combustible, pesada; después se cubre con litargirio ú óxido de plomo en bastante cantidad, se tapa y se pone al fuego; cuando nos parezca que todo el combustible se ha quemado retiramos el crisol, y después de frio encontraremos una porcion de plomo que se podrá separar fácilmente del litargirio que haya quedado en el crisol; este plomo proviene del óxido reducido, y como sabemos por la química que una cantidad de carbon reduce 34 veces su peso de plomo, no hay mas que pesar el obtenido y partir por 34 para saber el carbon que tenia el combustible. Supongamos que se ponen 10 gramos de madera en un crisol y encima litargirio, y que después de calentar de modo que toda la madera se queme, resulta un boton de plomo que pesa 136 gramos; tendremos, según lo dicho, que 136 : 34 = 4 es la cantidad de gramos de carbon contenidos en los 10 de madera, ó 40 en 100. Para determinar ahora la potencia calorífica, tendríamos que si l k de carbon da 7.200 unidades, 0,40 darán l k : 7.200 : : 0,40 : x = 2.880 unidades de calor, siendo este número la potencia calorífica de la madera ensayada; pero repetimos que no podria tomarse sino como aproximado.
501. Tablas de potencias caloríficas.
Se ha determinado la potencia calorífica de diferentes cuerpos empleando los métodos que hemos esplicado, y aun algunos otros; y comparando estos resultados con los que ha dado la práctica, se ha formado la siguiente tabla.
Hidrógeno......................................... 34.742
Aguarrás........................................... 10.800
Aceite de olivas................................ 9.700
Cera blanca...................................... 9.700
Sebo................................................ 8.500
Hulla término medio.......................... 7.500
Carbono........................................... 7.200
Carbon de madera............................ 7.000
Antracita........................................... 7.500
Alcohol............................................. 6.800
Hidrógeno bicarbonado..................... 6.600
Lignito............................................... 6.200
Cok.................................................. 6.200
Carbon de turba................................ 5.800
Turba seca........................................ 3.800
Turba, 20 por 100 de agua................ 2.800
Madera seca..................................... 3.600
Madera, 20 por 100 de agua............. 2.800
Azufre............................................... 2.600
Casca de tenería................................ 2.300
502. Calor radiado por un combustible.
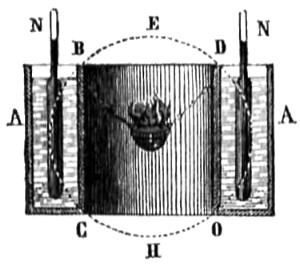
Es importante conocer el calor que radia un combustible al quemarse, como tendremos ocasion de ver en muchas aplicaciones; Peclet ha determinado este calor del modo siguiente: supongamos un vaso de hoja de lata anular A (fig. 246) lleno de agua; en el centro en un cestillo de alambre se coloca una cantidad de combustible cuyo peso será conocido, y se hace arder; el calor radiado le recibe la pared interior del vaso, que estará cubierta de negro de humo, y así le absorberá haciéndole pasar al agua, que se calienta, y se sabe su temperatura por los termómetros N de recipiente largo, que dan la media de toda la masa; de ella y del peso deduciremos las calorías que ha recibido el agua; pero es evidente que el calor total radiado por el combustible pasará á la superficie de una esfera BCHODE, que supondremos circunscrita á la superficie interior del vaso, y esta no comprende mas que una parte; calculando por tanto cuál es esta parte de la total, tendremos que si en ella se absorbe la cantidad de calor hallada en el agua, en la total se absorberá la cantidad que resulte del cálculo. Habrá que tener en cuenta en esta operación el calor absorbido por el vaso, como ya hemos hecho en otras análogas (498). Supongamos el vaso de 3 diámetros de altura BC y 2 de diámetro BD, que son las dimensiones del que ha empleado Peclet; resulta por el cálculo que siendo la superficie de la esfera 6, la correspondiente á la pared interior del vaso con las dimensiones marcadas es 5: en este concepto sean 2 kil. de agua la cantidad contenida en el vaso, y 8 los grados que ha subido; el calor recibido será 2 x 8 = 16 calorías: sea el vaso de 0k,3 de peso y su capacidad calorífica (405) la del hierro; el calórico absorbido por él será 0,3 x 8 x 0,11.379 = 0,273 de unidad, que con las que tenia el agua hacen 16 + 0,273 = 16,273; pero como la superficie que ha recibido calor es solo 5 partes de 6, que es el total de la esfera, tendremos que si 5 partes han recibido 16,273, las 6 recibirán 5 : 16,273 : : 6 : x = 19,544 unidades de calor; y este será el que hubiera recibido toda la superficie. Supongamos que el combustible fuera 6 gramos de carbon de madera ó sea 0k,006 si 0k,006 radia 19,544 unidades, lk radiará 0,006 : 19,544 : : 1 : x =.3.257 unidades: el calor total del carbon es 7.000, luego sería en este caso próximamente la mitad el calor radiado. El método que hemos seguido es como se ve el de las mezclas (401); por lo tanto hemos de tomar todas las precauciones que se han indicado para evitar errores en lo posible; Peclet ha determinado las cantidades de calor radiado por los diferentes combustibles, encontrando las siguientes, suponiendo 1 el calor total que puede dar el combustible.
Madera seca........................................................................ 0,28
Madera 20 p. % de agua; estado ordinario........................... 0,25
Carbon de madera............................................................... 0,50
Turba.................................................................................. 0,25
Carbon de turba;................................................................. 0,50
Hullas, antracitas, lignitos..................................................... Mas que el carbon de madera.
Cok con 15 p. % de ceniza................................................. Idem, idem.
503. Combustibles en particular. Madera.
La madera, según Payen, está compuesta de un tejido celular á que ha dado el nombre de celulosa, compuesto de algo mas que 4 décimas de carbon, y el resto de oxígeno é hidrógeno en las proporciones del agua; en las celdillas de la celulosa se encuentra otra sustancia á la que ha llamado materia incrustante, muy varia en su composicion según las diferentes maderas, pero que en general tiene algo mas de carbono que la celulosa, y una pequeña cantidad de hidrógeno en esceso. Una madera seca de encina del Pardo, cortada de un año, que hemos ensayado, nos ha dado: agua 0,240; carbon 0,385; oxígeno é hidrógeno en las proporciones del agua, 0,353; cenizas 0,022. En una madera de olivo cortada tambien de un año hemos encontrado, agua 0,274; carbon 0,332; oxígeno é hidrógeno en las proporciones del agua 0,37; cenizas 0,024. Estos resultados, bastante conformes con otros que se han hecho de diferentes maderas, dan idea de su composicion como combustibles; pero es evidente que los números son variables en cada madera, y en cada localidad, sin embargo podremos en general decir que una madera no tendrá mas de 40 por 100 de carbon, y generalmente menos; que por seca que se encuentre, contendrá 20 á 25 por 100 de agua; y que la cantidad de ceniza variará mucho, sobre todo en las aplicaciones, pues no es lo mismo ensayar un pequeño pedazo escojido, que tomar grandes cantidades; y como prueba citaremos la encina del Pardo, que ensayada en pequeña cantidad nos dió, como hemos dicho, 0,022 de ceniza, y quemando algunas arrobas resultó 0,053; el olivo dió 0,023, y algunas arrobas, 0,070. Consiste esta diferencia principalmente en la tierra y demás cuerpos estraños unidos á los pedazos grandes. Además, la cantidad de ceniza no es la misma en cada una de las diferentes partes del árbol, pues según resulta de algunos análisis que citan varios autores, 1.000 partes en peso de encina dan. el tronco 2, las ramas mondadas 4, la corteza 60. La cantidad de agua que contiene una madera, si no se conoce puede dar lugar á pérdidas de consideracion; ensayadas algunas, nos han dado:
RECIEN CORTADA.
SECADA AI. AIRE DOS MESES.
ENCERRADA UN AÑO.
ENCERRADA ALGUNOS AÑOS.
Encina del Pardo.
0,37
0,30
0,24
0,22
Fresno.
0,385
0,31
0,275
0,22
Olivo.
0,41
0,32
0,274
0,236
Pino.
0,423
0,324
«
0,215
Al lomar una madera debe ensayarse la cantidad de agua que contiene para ponerla precio, pues no ha de pagarse lo mismo la que tenga 1/5 de agua que la que tenga cerca de una mitad; para este ensayo se hace serrin fino una porcion de ella que se pesa con exactitud, y que deberá ser, si es posible, en cantidad algo crecida, siquiera 2 ó 3 onzas; después se pone en un recipiente cualquiera, si puede ser metálico, y se calienta á una temperatura poco superior á 100 grados; podrá ponerse el recipiente en un baño de aceite ó de agua y sal (428), haciendo hervir en este último caso; cuando el serrin, que se tendrá cuidado de revolver continuamente, no desprende vapores, se pesa de nuevo, y la pérdida será el agua que contiene. La madera húmeda es además de cara, por pagarse el agua al precio de ella, mal combustible, porque para vaporizarse el agua que contiene es necesario que emplee una cantidad grande de calor, que el vapor hará latente, y esta cantidad será perdida para el efecto útil que ha de producir. Resulta de lo dicho, que las maderas recien cortadas serán malos combustibles, pues deben tenerse lo menos un año secando, y deberán cortarse en otoño ó invierno, antes que empiece el movimiento de la savia: es preferible no encerrarla, sino hacerla pasar el verano al aire para que pierda su agua; y no importa mucho que se moje con la lluvia, pues esto no impide que pierda la humedad que naturalmente tiene.
504. Productos de la combustion de la madera.
Haciendo arder la madera al aire, el agua que contiene se evapora, el oxígeno é hidrógeno se combinan y forman agua, y si el hidrógeno está en esceso toma oxígeno del aire y tambien se convierte en agua; el carbono con el oxígeno del aire forma ácido carbónico, gas que se desprende con los vapores de agua, quedando solamente los cuerpos incombustibles no volátiles, que son las cenizas. Si la cantidad de oxígeno ha sido menor que la necesaria para formar estos productos, habrá otros, como el ácido piroleñoso y óxido de carbono, y algunas maderas podrán producir en estado de vapor, ó destilar, resinas, breas, y los productos de ellas. Todos estos residuos con algunas partes del carbono dividido y arrastrado mecánicamente por los gases, forman lo que se llama el humo. La madera dividida, como ramas ó pedazos pequeños, arde mejor, porque el aire penetra por entre el combustible y da una llama larga, muy útil en algunos casos. La madera es un combustible escelente, por producir mucho calor en poco tiempo; pero es necesario grande vigilancia en los hogares, porque arde pronto y hay que renovarla á menudo; los residuos de su combustion la hacen impropia para algunos usos é industrias. La madera, sea compacta ó floja, da siempre la misma cantidad de calor en peso igual, si esta enteramente seca, ó en el mismo estado de desecacion; por tanto es un error suponer que las maderas flojas, el pino por ejemplo, producen menos calor que la encina; en igual volumen es así por ser mayor la densidad de la última, pero no en igual peso. La potencia calorífica de la madera queda indicada (501), y tambien el calor que radia (502).
505. Paja y otros combustibles semejantes.
La paja, estiércol, yerbas y otros combustibles semejantes, aunque divididos, suelen formar una masa compacta que arde solo en la superficie ó lentamente en el interior, produciendo humo: estos combustibles pueden compararse á las maderas en su composicion y potencia calorífica, pero son malos porque dan mas cenizas, por la vigilancia que necesitan los hogares, el mucho volumen, los productos de su combustion, y por otras varias causas; pero no son enteramente despreciables en la industria, y sobre todo en ciertas localidades, por su bajo precio: podemos citar una máquina de vapor cuya fuerza es de 4 caballos, que sirve de motor en un buen taller de Madrid, y no gasta mas que estiércol como combustible, cuyo precio es muy bajo.
506. Carbon de madera.
Haciendo arder la madera de modo que el aire sea solo en pequeña cantidad, el agua, oxígeno é hidrógeno y demás cuerpos volátiles se marchan, y quedan solo el carbono y las cenizas, formando lo que se llama carbon; según esto, la transformacion de una madera en carbon, ó sea la carbonizacion, no es mas que la separacion de los principios volátiles y fijos por medio del calor, el cual es producido por la combustion de una parte de la madera empleada, pudiéndose tambien hacer la misma separacion por medio del calor producido por otro combustible que no sea una parte del que se carboniza, siempre que se disponga la operacion del modo conveniente; examinaremos después estos dos métodos.
507. Propiedades del carbon.
El carbon es un sólido que arde sin llama formando ácido carbónico, que es un gas invisible, ó con una llama azulada si no encuentra bastante oxígeno para arder, que es la del óxido de carbono que forma en este caso: puede tener agua, y tambien algo de hidrógeno, que se convertirá en agua al arder, pero esta formará tambien vapor invisible, y de aquí resulta que los residuos de la combustion del carbon son gases invisibles, y por esto se dice que no forma humo: estas y otras causas le hacen emplear para muchos usos en que no sirve la leña, y así se esplica el que se fabrique carbon á pesar del gasto que ocasiona en el combustible quemado y en la mano de obra necesaria para la operacion. El buen carbon se conoce por su dureza y sonoridad, no se rompe fácilmente, y es brillante en su fractura; si está muy quemado se rompe y hace mucho cisco, es menos compacto, y toma mucha humedad; y si está poco quemado tiene tizos, y no se puede usar en ciertas aplicaciones. Las leñas empleadas para el carboneo generalmente son las duras ó compactas, como la encina, fresno, roble, haya y olmo; pero en algunas localidades también se forma el carbon de maderas ligeras, sobre todo del pino; estas últimas dan carbones esponjosos que arden rápidamente, y por esto no son en general tan buenos como los otros: 1 metro cúbico de carbon de encina pesa 240 á 250 kilogramos, y 1 metro cúbico de carbon de pino pesa 200 á 210; esto indica tambien la ventaja de comprar el carbon al peso, como se hace en España, y no al volumen. Cortada la leña se carboniza en seguida ó se deja secar: si lo primero, no da generalmente tanto carbon porque se gasta gran parte en vaporizar la mucha agua que contiene, de modo que es preferible lo segundo, a pesar de que el capital debe estar mas tiempo empleado, pero el mayor rendimiento compensa con ganancia: en España, sin embargo, es lo general cortar cuando se va á carbonizar. Los troncos delgados son los que dan el carbón llamado de canutillo, que es el preferido por su buena carbonizacion y admitir menos cuerpos estraños á causa de su forma; los carbones llamados de arranque, que son los de raices y aun de troncos gruesos, suelen tener mas tierra, y no son tan estimados; los de rama menuda producen el carbon que se llama generalmente cisco de tahona, que es residuo de otras fabricaciones y no se prepara directamente.
508. Carbonizacion en pilas.
La carbonizacion de la madera haciendo arder una parte de ella para carbonizar el resto se ejecuta en el monte mismo, pues el trasporte del carbon es mas económico que el de la leña que le produce, por su peso menor. En un terreno llano é igualado al efecto, y despejado de leñas que puedan arder, so forma una pila de la que se ha de carbonizar; pero de la formacion de esta pila depende mucho el buen éxito de la operacion. Igualado el suelo se pone sobre él una capa circular de leña gruesa, de modo que los maderos estén colocados desde el centro afuera; en medio se coloca vertical un tronco grueso, y alrededor de él se van colocando también verticalmcnte las leñas cortadas iguales y bien juntas; si las leñas no son rectas se acomodan mejor echadas horizontalmente siempre en direccion del centro afuera: de una manera ó de otra se pone la leña gruesa debajo, y así la pila es mas estrecha en la parte superior; si se quiere mas alta se pone otro leño sobre el del centro, y se continúa del mismo modo. El tamaño de estas pilas es muy variable, pero en las pequeñas se conduce mejor la operacion, y en las grandes hay un poco mas de rendimiento. Ya concluida la pila se cubre por la parte esterior con tierra húmeda ó con la tierra mezclada de cisco de otra operacion, y si es poco arcillosa se toma en mantas de la superficie del terreno con la yerba que contiene; al cubrir la pila hay que dejar algunas entradas para el aire, sobre todo hacia la base: en este estado se saca el leño del centro y se echa leña menuda, á la que se prende fuego; este toma aire de las entradas de la base por entre los maderos que forman la pila, y á poco tiempo empieza a propagarse la combustion desde el centro, en cuyo caso se va tapando con tierra este centro y las aberturas mas cercanas á él, cubriendo después las inmediatas á estas y así sucesivamente para que vaya ardiendo la pila por igual en toda su estension; si se ve que arde mas de un lado que de otro se echa tierra sobre el punto que da mas humo. Esta operacion, que dura algunos dias, exije la mayor vigilancia, pues los resultados dependen de ella; por tanto es necesario práctica para conducirla bien, pues descuidada podia dar por resultado un monton de ceniza. Si hay viento, suele encenderse mas en el lado por donde viene, y la carbonizacion no se puede llevar por igual habiendo á veces grandes pérdidas; por eso debe elegirse un terreno resguardado, si es posible, para formar la pila. Hemos visto en algunos puntos colocar pantallas de tablas por el lado del viento para evitar en parte sus efectos. Cuando la tierra del esterior está hecha brasa y no sale humo de la pila, se cubre con nueva tierra hasta que se logra apagarla, en cuyo caso está concluida la operacion. El carbon en este estado no tiene agua, pero bien pronto la toma del aire, y así despues de algun tiempo la tiene en cantidades variables según las circunstancias, pero que pueden ser entre 2 y 12 por 100 en peso. Una operacion bien dirigida produce 17 á 18 por 100 de carbon en peso de la leña empleada: algunos fabricantes dicen que se obtiene el 25, porque cuentan 1 arroba de carbon por cada 4 de leña; pero los mejores métodos, como veremos á continuacion, no producen tanta cantidad de carbon, mucho menos siendo leñas recien cortadas; la poca exactitud en medir la leña empleada, el dejar al raso el carbon despues de fabricado, que toma agua en bastante cantidad, y la piedra y tierra que se recojen con el carbon, deben ser la causa de que se cuente este rendimiento, que no puede resultar de carbon puro.
509. Pilas de fabricacion continua.
De otro modo se hace tambien la carbonizacion en pilas, y es preferible cuando no hay un lugar bastante resguardado del viento: consiste en hacer las pilas rectangulares en vez de circulares, dándoles 2 ó 3 varas de ancho y 12 ó mas de largo. Si la madera es resinosa es conveniente disponerla en un terreno algo inclinado; la leña se apila tendida mas bien que de punta, empezando por una altura de 1 vara y acabando en 2 ó 3 según la longitud, de modo que formará un plano inclinado por la parte superior; después se clavan estacas al rededor de la pila y se meten tabletas formando una caja, dejando entre ellas y la leña un hueco para echar tierra, que se apelmaza bien: poniendo encima otra capa de tierra que esté muy apisonada queda la leña perfectamente cubierta; preparada la pila de esto modo se abre una especie de hogar en la parte mas baja de ella, y se hacen dos ó tres aberturas en la cubierta de tierra y á la distancia de 1 ó 2 varas; cuando ha empezado á arder se tapa el hornillo y se ve salir humo negro por las aberturas, que después se va haciendo blanco, en cuyo caso se tapan estas salidas y se hacen otras mas adelante, siguiendo del mismo modo hasta el fin de la pila, de manera que la carbonizacion se va haciendo sucesivamente, y cuando llega á 4 ó 5 varas del principio puede sacarse el carbon ya fabricado al empezar, y tambien se puede estar sacando carbon de un estremo y formando la pila en el otro, por lo que la fabricación será continua para mucha cantidad de leña. La cubierta preserva del aire; por eso este método, que en igualdad de circunstancias produce un poco menos carbon, puede ser preferible cuando no hay un punto abrigado para hacer la pila; además es mas económico en mano de obra. La cubierta debe regarse para que las tablas no se quemen, y servirán varias veces. En todas las pilas ha producido buen resultado colocar entre las capas de leña, cisco de otra fabricacion ó ramage inútil, que nada vale, y sirve de combustible para hacer carbonizar la leña, gastándose esta menos.
510. Maderas resinosas.
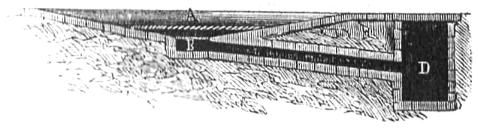
En Francia en algunas localidades y particularmente en las Landas, donde hacen carbon de pinos muy resinosos, forman la pila sobre un espacio preparado para recojer las breas. Se compone de una era algo cónica A (figura 247), que tiene en su centro un pequeño espacio B del cual sale un conducto que comunica con un foso D, en donde se reúnen las resinas destiladas por las maderas; formada la pila encima de la era A, sobre la que se suelen colocar algunas barras de hierro para que corra mejor la resina por debajo, podrá recojerse esta, y es un producto mas, cuyo coste puede decirse que es nulo, pues una vez preparada la era de piedra ó ladrillo dura mucho tiempo.
511 Carbonizacion en espacios cerrados.
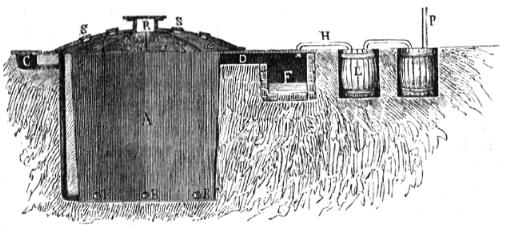
Entre los productos de la combustion de la madera cuando le falta aire, es uno, compuesto de hidrógeno, carbono y oxígeno, el ácido piroleñoso (504), ó vinagre de madera, el cual puede sustituir al vinagre en muchas industrias, por lo que se fabrica espresamente del modo que después diremos, sin que en este caso se tenga cuenta del carbon producido mas que como un producto secundario; pero cuando el carbon es el principal producto, es decir, en la fabricación de este, se pierde el ácido por el método que hemos espuesto de carbonizacion en pilas, ó se recoje en parte empleando otros medios que, si bien dan este producto mas, son embarazosos para los obreros no acostumbrados, y á veces no es posible preparar lo necesario en el punto donde se ha de carbonizar: por eso es poco empleado el método de carbonizacion recojiendo los productos de la combustion, pero sin embargo daremos una idea de él, porque puede ser útil en algunos casos, describiendo, de entre los varios aparatos que se han empleado, uno que es de los que mejores resultados han producido, y es fácil de construir. Se compone de un pozo algo cónico A (fig. 248) formado en un terreno arcilloso ó duro, y así no necesita revestimiento; sus dimensiones pueden ser 10 ó 12 pies de profundidad, 13 ó 14 de diámetro en la parte superior y 10 ó 12 en la inferior; al rededor de este pozo se colocan tubos B introducidos en la tierra y que llegan hasta el fondo, los cuales en la parte superior comunican con unas aberturas C hechas en la misma tierra; á un lado se hace el canal D cerrado con una plancha de hierro ó piedra, el cual terminará en el recipiente F abierto en la misma tierra, que debe estar revestido; este recipiente comunica por el tubo H con el tonel L, y este tonel con otros del mismo modo, siendo varios los que pueden colocarse, y dentro ó fuera de la tierra, según se crea mas conveniente. El pozo A se tapa con una cubierta de hierro N, la cual tiene una abertura R en el centro y otras pequeñas S repetidas en su superficie, con tapas que puedan abrirse fácilmente. La leña que se ha de carbonizar se coloca en A vertical ú horizontal según se acomode mejor por su forma, pero se cuida de dejar en el centro un espacio como hemos dicho en las pilas (508); colocada la leña se echa fuego en este espacio del centro, se tapa con la cubierta N y se tienen abiertos los agujeros S y R; el aire que se eleva sale por S y R y es llamado por C y B á la parte inferior de la leña, de modo que pronto empieza a salir humo y entonces se tapa R; la combustion sigue, y cuando sale mucho humo por las aberturas S se tapan todas, ó por lo menos aquellas por donde sale mas, hasta que arda la pila por igual; cerradas todas las aberturas S, los restos de la combustion tienen solo la salida D, y depositan las breas como menos volátiles en F; él ácido y los demás gases pasan á los toneles L donde quedan condensados, y los gases no condensables salen del último tonel por un tubo P; despues que la carbonizacion está concluida, lo que se conoce viendo si la leña ha bajado por igual, y si no sale humo por el tubo P, se abren todos los orificios S para que salgan los gases que hay retenidos bajo la cubierta, los que hacen rojizo el carbon, y cuando se ve que la superficie de este se ha hecho ascua se tapan las entradas C por medio de planchas de hierro ó piedras y el carbon se apaga. Damos á continuacion las dimensiones de uno de estos pozos que hemos tenido ocasion de examinar.
Profundidad............................................ 3 m. 11 pies próximamente.Para las maderas resinosas puede añadirse a este aparato un fondo como en la figura 247, y se rocojerán las resinas al principio de la operacion.
Diámetro superior................................... 3,50 12 1/2 pies.
Diámetro inferior..................................... 3 11
Tubos B ....................Su diámetro.......... 0,04 20 líneas.
Su número............. 7
Abertura R, su diámetro.......................... 0,3 1 pie.
Aberturas S, su diámetro......................... 0,05
Diámetro del canal D.............................. 0,3
Carbon producido........................ 20 por 100 en peso.
Líquidos ó ácido sin purificar........ 18 por 100 en peso.
Duracion de la operacion....Carbonizar...... 2 1/2 á 3 días.
Apagar .......... 3 á 4 días.
512. Carbon, residuo de ácido piroleñoso.
En la fabricacion del ácido piroleñoso se emplean cilindros cerrados ú otros recipientes semejantes para destilar la madera, resultando carbon que, si bien no es de tan buena calidad como el fabricado por otros medios, es sin embargo un buen combustible.
513. Carbon rojo.
En algunos puntos de Francia han empleado para la fabricacion del hierro un combustible que han llamado madera tostada ó carbon roux, y que nosotros llamaremos carbon rojo, porque su color es rojo oscuro; este carbon ha producido muy buenos resultados. Se fabrica haciendo que los gases perdidos de los altos hornos pasen calientes por la madera, poniendo esta, por ejemplo, en cajas de hierro al rededor de las cuales pasa el gas caliente, ó tambien colocando la madera sobre carretones de hierro en conductos por donde se hacen pasar los gases. La madera debe perder el 40 ó 50 por 100 de su peso para trasformarse en este carbon; y como el trasporte del peso total se paga hasta la fábrica, resulta que la economía que proporciona este combustible queda compensada con el gasto de trasporte y fabricacion, por cuya razon produce pocas veces ventaja positiva el emplearle. La potencia calorífica del carbon queda indicada (501), lo mismo que la cantidad de calor que radia (502).
514. Hullas.
Se da el nombre de hulla ó carbon de piedra á un combustible de origen sin duda ninguna vejetal, pero que se encuentra formando capas á veces de grande estension y grueso en los terrenos que llaman la formación carbonífera en la parte superior de los de transicion; á la porcion de estos terrenos que contienen la hulla, suelen tambien designarlos con el nombre de terrenos de hulla, pues encima y debajo se encuentran otros combustibles de diferentes propiedades. Las hullas carbonizadas producen el combustible llamado cok. La hulla arde difícilmente si se encuentra en pequeña cantidad, y es necesario que el aire tenga fácil acceso para que no se apague.
515. Diferentes clases de hullas.
La hulla es el combustible mas precioso en la industria por su riqueza en carbon y el bajo precio a que puede obtenerse en las localidades donde se esplota; pero no tiene siempre las mismas propiedades, y por eso se escoje la mas á propósito, si es posible, para cada uso particular. Se dividen generalmente en 5 clases.
1.ª clase. Hullas grasas. Estas al arder forman como una pasta y producen cok muy esponjoso, y no de muy buena calidad; quemadas sobre rejilla se adhieren á ella y la obstruyen si no se tiene mucha vigilancia, destruyendo también los hierros de ella: producen un escesivo calor, y por esto son escelentes para fraguas y hornos de reverbero; tienen un aspecto graso particular.
2.ª clase. Hullas grasas de llama larga. Estas hullas no se hacen apenas pastosas, y producen un cok que no es tan esponjoso, pero sin embargo es de mala calidad; arden bien en rejilla, y por su llama larga son muy buenas en varias industrias, y tambien son las mejores para la fabricacion del gas de alumbrar; su aspecto es bastante semejante al de las anteriores.
3.ª clase. Hullas grasas duras. Las hullas de esta clase no funden mucho al arder y producen un cok poco esponjoso y bastante denso, que se emplea muy ventajosamente en las operaciones metalúrjicas. Son estas hullas las mejores bajo todos conceptos para fabricar el cok.
4.ª clase. Hullas secas de llama larga. Arden con llama en el primer momento y dan un cok que se rompe fácilmente; no producen tanto calor como las anteriores, y por eso no son buenas para operaciones metalúrjicas, pero lo son en otras operaciones que no necesitan una temperatura tan elevada, por ejemplo para producir vapor.
5.ª clase. Hullas secas sin llama. Arden con dificultad y dan un cok enteramente pulverulento; pueden emplearse á pesar de sus malas cualidades en algunas fabricaciones semejantes á la coccion de cal ó ladrillo; también se emplean en Inglaterra para las chimeneas domésticas por su bajo precio.
516. Composicion de las hullas.
La composicion de la hulla, segun el resultado de muchos análisis, es bastante variable en la cantidad de sus componentes; pero todas tienen carbono, hidrógeno, azoe y agua, ó bien oxigeno ó hidrógeno en las proporciones del agua; además contienen otros cuerpos no combustibles que constituyen la ceniza.
La tabla siguiente presenta la composicion de las cinco clases de hullas, habiendo tomado el mayor y menor número de los que han dado muchos análisis y esperimentos: se suponen estos números, resultado de 100 partes analizadas.
Densidad.
Peso del cok producido por 100.
Carbono.
Hidrógeno total.
Hidrógeno libre.
Oxígeno.
Azoe.
Ceniza.
Potencia calorífica.
Hullas grasas.
De 1,28 á 1,31
66 á 68,5
87,4 á 88
4,84 á 5,26
4 á 4,5
3,4 á 4,4
1,5 á 2
l,44 á l,8
7.430 á 7.920
Grasas de llama larga.
1,27 1,36
53 67,5
81 85
4,98 5,67
3,55 4,70
4,5 10,3
1,5 2
0,5 5,54
7.160 7.850
Grasas duras.
1,30 1,33
73 76,3
87,8 89,3
4,84 4,90
4,22 4,30
2,3 4,5
1,5 2
1,4 3
7.790 7.890
Secas de llama larga.
1,32 1,37
54,5 55
76,3 76,6
5,08 5,24
3,06 3,10
13,5 14,6
1,5 2
2,2 2,5
6.550 6.690
Secas sin llama.
1,36 1,45
51 51,5
63 63,4
4,30 4,38
2,71 2,78
17 17,7
1,5 2
19 19,5
5.290 5.590
Las hullas suelen contener á veces azufre, generalmente en pirita de hierro, y en este caso no son buenas especialmente en metalurgia, porque trasladan su azufre á los metales y resultan estos agrios y de mala calidad; empleadas para calentar calderas ó vasos metálicos, tambien los atacan y destruyen pronto; al esplotar estas hullas el sulfuro se cambia en sulfato de hierro al contacto del aire húmedo, y se desmorona reduciéndose a cisco, produciendo un calor que á veces puede ser suficiente para encender la hulla.
517. Hullas estranjeras.
Inglaterra y Bélgica son los paises en que hasta el dia se ha encontrado mas estension de terrenos de carbon esplotable relativamente á su superficie. En Inglaterra se calcula como carbonífera la vigésima parte de su estension; los Estados-Unidos tienen mucho carbon en capas de gran potencia y fáciles de esplotar. Se encuentran hullas en todas las latitudes, lo mismo hacia los polos que en el Ecuador, pero no se han encontrado en Suecia, Noruega, Italia, Grecia y mucha parte del territorio ruso. Inglaterra esplota en el dia mas de 500 millones de quintales españoles de hulla y consume 400, esportando los 100 restantes; la Bélgica esplota mas de 65 millones; la Francia 9, y consume sobre 130, haciendo una importación de 40 millones próximamente y una esportacion de 1 millon.
518. Hullas españolas.
En muchos puntos de España se han encontrado criaderos de gran estension que dan escelentes carbones. El punto mas importante en el dia es Asturias, en donde se encuentran en una estension de 12 á 13 leguas de longitud por mas de 6 de ancho, si bien las capas están interrumpidas en varios puntos; el número de estas es grande, y algunas de bastante potencia; los puntos notables son los concejos de Langreo, Siero, Mieres, Lena, Tudela, Llanera y Avilés. Se esplota para el consumo del país, esportándose además una cantidad que pasa de 2 millones de quintales al año; cuesta próximamente 1 real á la boca de la mina, pero en algunos puntos, como Mieres, sale escasamente á 16 mrs. el gasto de esplotacion por quintal. En Cataluña se encuentra en la cuenca de San Juan de las Abadesas, en una estension de 4 leguas que sigue después hasta Francia en otra estension igual, pero poco estudiada, desarrollándose de nuevo junto al pueblo francés llamado la Manera, en cuyo punto se esplota. En San Juan se han descubierto hasta unas 8 capas, cuyas potencias son desde 1 metro á 18; en el Pla den Dolce es de 17 metros. El criadero se encuentra á la margen derecha del rio Ter, a una distancia de 12 ó 15 horas del puerto de Rosas y 22de Barcelona; los puntos notables son Mare de Deu, Juncá, Pinté, Covas, Pla den Dolce, y Gallina. Se emplea en las industrias del pais, pero la esplotacion es todavía reducida y cuesta en la mina 3 á 3 1/2 rs. quintal, aunque pudiera esplotarse á menos precio: esta es la causa de que en la industria catalana se consuman muchos miles de quintales de hullas inglesas, á pesar de tener en el mismo territorio tan buenos criaderos. En la provincia de Córdoba están los criaderos de Espiel y Belmez, en una estension de 14 leguas, y á 6 de Córdoba, produciendo ricos carbones que se consumen en Jaén, Linares, Almadén y algunos otros puntos; en la mina puede darse á 2 reales quintal, y en Madrid, á donde se ha conducido alguna cantidad, sale de 24 á 28 reales. En Palencia están los criaderos de Orbó en una estension de 20 leguas, pero muy interrumpidos; produce escelentes carbones que se consumen en Valladolid, Madrid y algún otro punto, pero se esplota poco á causa de la falta de medios fáciles para el trasporte; en la mina cuesta 1 real quintal poco mas ó menos, y en Madrid, término medio, á 20 reales. En León están los criaderos de Sabero, en una cuenca de 4 leguas que produce escelentes carbones pero que se esplotan poco, pues su mayor consumo es para la fábrica de la sociedad Palentina-Leonesa. En Santander también se encuentran los escelentes carbones de Reinosa, que se esplotan para el consumo de alguna fábrica, y se trasporta algo á Madrid, donde ha costado de 19 á 22 rs. quintal. En la provincia de Sevilla se encuentra la cuenca de Villanueva á 4 leguas de Sevilla en la ribera del Guadiato, que en una estension de 1/2 legua produce carbones muy bituminosos que se emplean en Sevilla para alguna fábrica y para la navegacion. En la provincia de Cuenca, en Hinarejos, se encuentran tambien hullas, pero no se esplotan por no tener consumo. En Vizcaya hay carbones, aunque en pequeña cantidad. Pudiéramos citar todavía muchos puntos donde se encuentran hullas, pero los criaderos son pobres ó no se esplotan, y por tanto no tienen importancia. Tampoco es posible clasificar las hullas de los criaderos que hemos citado, pues en muchos de ellos se encuentran hullas de todas clases, lo que no es de estrañar teniendo en cuenta su mucha estension y las diferentes capas en que se hallan por lo general; pero podremos decir sin temor de equivocarnos, que en España se pueden tener carbones tan buenos como en otros paises, y de fácil esplotacion: como el trasporte hace subir mucho su precio en los puntos que debieran ser los centros de la industria, y como el consumo es poco por esta razon, las esplotaciones se hacen en muy pequeña escala en la mayor parte de los criaderos, y esto tambien aumenta el precio. Presentamos á continuación los resultados que hemos obtenido en muestras de diferentes criaderos, pero es evidente que no bastarán para formar una idea exacta de las hullas que estos producen, puesto que, como hemos dicho, varían las calidades en una misma esplotacion á cada punto; las observaciones por tanto se refieren á los ejemplares que nos hemos procurado, de los cuales debemos bastantes á la complacencia de algunos de nuestros buenos amigos, lo mismo que varias noticias interesantes sobre este particular.
En la siguiente tabla, las cantidades de cok, gases y cenizas, son en peso por 100, y la potencia calorífica se ha determinado por la reduccion del óxido de plomo (500).
Nombre de la localidad.
Provincia.
Peso especifico
Cok producido.
Gases volatilizados.
Cenizas.
Potencia calorífica
OBSERVACIONES.
Langreo.
Asturias.
1,2483
70
30
6,2
6.387
Laminosa brillante, algo frágil, 4.ª clase.
Mieres.
Asturias.
1,2321
64
36
5
7.072
Laminosa compacta, 2.ª clase.
Avilés.
Asturias.
1,3072
67
33
6
7.103
Bastante grasa, cok esponjoso, casi 1.ª clase.
Mare de Deu.
Gerona.
1,2735
72
28
4,3
7.040
Bituminosa, buen cok 3.ª clase.
Juncá.
Gerona.
1,3172
78
22
4
6.967
Compacta brillante, 4.ª clase.
Pinté.
Gerona.
1,2965
73
27
6,5
6.802
Bituminosa, buen cok, 3.ª clase.
Covas.
Gerona.
1,3476
70
30
7,2
5.841
Compacta, algo piritosa casi 5.ª clase.
Pla den Dolce.
Gerona.
1,5637
64
36
13,5
5.256
Compacta piritosa, 5.ª clase.
Gallina.
Gerona.
1,4275
69
31
9
5.268
Bituminosa algo piritosa 2.ª clase.
Espiel.
Córdoba.
1,3256
68
32
4,3
7.328
Compacta laminosa, 2.ª clase.
Orbó.
Palencia.
1,2727
65
35
5,6
6.897
Compacta dura, 2.ª clase.
Sabero.
León.
1,2738
67
33
6,2
6.902
Compacta brillante, 2.ª clase.
Reinosa.
Santander.
1,3019
62
38
4,3
7.005
Laminosa frágil, buen cok, 3.ª clase.
Villanueva del Rio.
Sevilla.
1,2708
65
35
6.7
6.798
Muy bituminosa, 2.ª clase.
Hinarejos.
Cuenca.
1,3857
62
38
7,3
6.683
Compacta laminosa, 4.ª clase.
Vizcaya.
«
1,3148
63
37
5,1
6.582
Escamosa brillante, dura, 4.ª clase.
519. Potencia calorífica de la hulla.
Para buscar la potencia calorífica de la hulla no se puede emplear el método del calorímetro de Rumfort (498), porque no es posible hacer arder este combustible en pequeña cantidad; es necesario recurrir á su composicion (499), lo que exije un análisis detenido, ó emplear el método de la reduccion del óxido de plomo (500), aunque no es muy exacto; este hemos empleado por mas sencillo en los números que hemos dado, pero el mejor modo de apreciar la potencia calorífica de una hulla será estudiar el efecto producido en las aplicaciones. Como resultado de los métodos indicados y de observaciones, hemos dado (501) el número 7.500, que es el que se toma generalmente en los cálculos; sin embargo, deberá disminuirse para hullas que no sean grasas de buena calidad.
520. Calor radiado por la hulla.
No ha sido tampoco posible quemar la hulla en el aparato de Peclet (502) para determinar el calor radiado, pero segun esperimentos directos se ha visto que puede tomarse un número algo mayor que el del carbon; sin embargo, como no está determinado exactamente tomaremos siempre que sea necesario la mitad del calor producido, lo mismo que para el carbon de madera.
521. Cok.
Ya hemos dicho que el cok es un combustible que resulta de la carbonización de la hulla (514), ó lo que es lo mismo, de quitarla por medio de la calcinacion todos sus principios volátiles como se quitan á la madera para formar el carbon. Este combustible arde con dificultad si no está en bastante cantidad, y como se compone en su mayor parte de carbon arde sin llama. El cok debe ser denso y duro, porque en los usos á que se destina hay generalmente mucha corriente de aire, como en caminos de hierro y operaciones metalúrgicas; para estos casos no sería bueno un cok poroso y ligero, y solo puede emplearse en otros usos donde es menor la corriente. Otra condicion indispensable en el cok es que sea puro, sin mucha ceniza ni cuerpos estraños; en algunos paises baja el precio del cok segun la ceniza que contiene, siendo malo el que pasa de 5 á 7 por 100; y para conocer la importancia que se da á un buen cok, citaremos el ejemplo de algunos caminos de hierro franceses, quo lo toman inglés á un precio mas elevado que el de su pais, porque está mas puro y contiene menos ceniza.
522. Fabricacion del cok.
Para obtener un cok de buena calidad se escoje la hulla en pedazos gruesos, y así puede separarse fácilmente todo cuerpo estraño: en algunas fábricas someten también la hulla á un lavado semejante al de los minerales, con el objeto de separar todos los cuerpos mezclados con ella, que por su mayor densidad bajan al fondo de los aparatos lavadores; de este modo aprovechan tambien en la fabricacion del buen cok, carbones mas menudos, lo que nada importa porque el tamaño de la hulla no es el del cok, puesto que al arder se aglomera y produce pedazos gruesos. La carbonizacion de la hulla se hace en pilas, ó en largos montones como la de la madera (508, 509); pero es necesario que el aire tenga fácil entrada; en algunos puntos forman una chimenea cónica de ladrillo con anchas aberturas, la cual tiene l 1/2 metros de alta y 3 á 4 decímetros de diámetro superior; al rededor de esta se apila una porcion de hulla en un monton de 5 á 6 metros de diámetro, cubriéndole con cisco menudo de ella misma; despues se da fuego por la chimenea, teniendo cuidado de hacer algunas entradas para el aire en la cubierta del cisco que tapa el monton, y cerrando la chimenea cuando ha empezado el fuego á ser intenso; á los 3 días está formado el cok, y entonces no hay mas que estenderle si el espacio lo permite, y se apaga por sí solo; tambien suele apagarse con agua, lo que será preferible si la hulla tenia azufre, para quitar en parte el que pueda contener el cok. Se hace tambien la carbonizacion en largos montones practicando algunas aberturas en su estension, ya formadas con los pedazos gruesos de la hulla, ó ya colocando estacas al formar la pila, que se sacan despues; la cubierta se hace como antes hemos dicho, y se da fuego por un estremo ó por varios puntos á la vez; despues se apaga como en el método anterior. Por estos medios se obtiene el 45 al 60 por 100 del cok en peso, segun la especie de hulla y el modo de conducir la operacion; en cuanto al volumen suele ser por lo menos igual al de la hulla empleada, y en las grasas escede á veces bastante del de esta.
523. Fabricacion del cok en hornos.
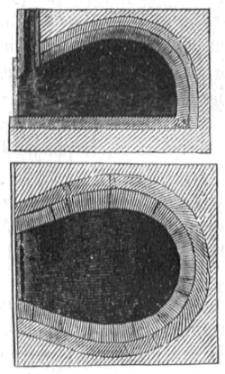
Otro método para fabricar el cok es calcinarlo en hornos, lo que tiene muchas ventajas: generalmente se emplea para fabricar el cok con las hullas menudas que no servirían para otra cosa. La cantidad producida es algo mayor que por los métodos antes dichos, y además pueden aprovecharse los residuos de la combustion, recogiendo las breas y sustancias amoniacales que resultan, y utilizando como combustible los gases desprendidos. Los hornos que se emplean para las hullas menudas son con pocas variaciones como el que representa la figura 249. Su forma es elíptica, y se cubren de una bóveda fabricada, lo mismo que el suelo, de ladrillo refractario; después se cubre con una capa de arcilla, y aun sobre esta puede ponerse arena y cubrir con ladrillo; la salida de los gases de la combustion puede hacerse por una pequeña chimenea colocada por delante ó por detrás, y de ella hacer pasar estos gases donde sea necesario, y si no á una chimenea general que los saque al esterior; por lo regular hacen muchos hornos unidos, y sus dimensiones varían bastante: para que puedan servir de tipo, indicaremos las de algunos que están funcionando muy bien. La longitud del suelo del horno es 3 metros y el ancho mayor 2; la mayor altura de la bóveda 1 metro. Las puertas, que son bastante espaciosas, sirven para cargar y descargar el horno, y además para dar entrada por sus junturas al aire para la combustion; se echa una capa de hulla de 1 1/2 á 2 decímetros dealtura, y el calor del horno de la operacion anterior sirve para inflamar la hulla, que arde 24 ó 36 horas, y despues se tiene enteramente cerrado el horno 12 horas para apagar el cok: al cabo de este tiempo se saca y acaba de apagar con agua, cargando enseguida de nuevo; si hay prisa puede hacerse la carbonización en 24 horas y descargar en seguida, pero no resulta un cok tan bueno: cuando los hornos son grandes la operacion suele durar 4 dias. Por este método puede obtenerse sobre el 60 por 100 del cok en peso, ó menos, según la calidad de la hulla; el volumen suele ser algo menor que por el otro método para hulla igual, pero algunas veces escede el volumen del cok al de la hulla empleada en mas de una cuarta parte. Cuando se ha de carbonizar hulla gruesa es conveniente hacer hornos mucho mas altos y cilíndricos, y practicar algunas pequeñas aberturas en sus paredes para que entre un poco de aire y se haga la combustion. Sea cualquiera el método empleado para carbonizar la hulla, ha demostrado la esperiencia que cuanto mas lenta es la operacion y mas gruesa lacapa de combustible, el cok resulta mas compacto y de mejor calidad; por esto los ingleses suelen carbonizar en grandes hornos y dar á la capa de hulla un grueso á veces de mas de 1 metro, y de este modo el peso de ella no deja hinchar el cok; además en los hornos, como el calor se encuentra en la bóveda, la carbonizacion empieza por la parte superior y se hace una capa compacta, que impide tambien la dilatacion del cok que resulta luego en la parte inferior. Suelen hacerse hornos para carbonizar en grandes masas, tambien de la forma que hemos dado (fig. 249), pero de una longitud hasta de 6 metros y las demás dimensiones en proporcion. Cuando se destinan las hullas para la fabricacion del gas del alumbrado, es el cok un producto secundario y no sale de tan buena calidad; generalmente se hace esta destilacion en cilindros circulares ó elípticos de hierro fundido ó de piedra, enteramente cerrados, y con solo un tubo de salida para los gases; estos cilindros se colocan en hornos que los calientan por el esterior. Muchas de las hullas que existen en España dan un cok escelente, y sobre todo escojiendo en cada criadero las que son á propósito; las de Mare de Deu y Pinté en Cataluña, muchas de Asturias, las de Sabero, Espiel y Reinosa, dan muy buen cok; en este último punto se fabrica al lado de la mina, y puesto en Madrid cuesta sobre 25 rs. quintal.
524. Potencia calorífica del cok.
La potencia calorífica del cok depende primero de su calidad y además de la cantidad de cenizas que produce, de modo que un cok denso y compacto que tenga 15 por 100 de ceniza no dará mas que 6.000 unidades lo mas, pero si no escede de 7 pueden contarse 6.200, como hemos indicado en la tabla (501), y aun podrán subirse hasta 6.500 si es de buena calidad; debe ensayarse para conocer la ceniza que contiene, antes de hacer uso de él. La misma dificultad que en la hulla (519) se presenta en el cok para conocer su potencia calorífica, porque arde difícilmente y no se puede conocer por medio del calorímetro.
525. Calor radiado por el cok.
No es posible conocerle por el método dicho (502), a causa de la dificultad con que se quema; pero aunque la práctica ha dado que radia algo mas que el carbon, se debe tomar solamente la mitad del producido.
526. Lignitos.
El lignito es una sustancia que se encuentra en capas mas modernas que la hulla, como son los terrenos terciarios y aun las partes superiores de los secundarios. El color de los lignitos es pardo ó negro, su aspecto terreo y su masa es mas ó menos homogénea, conservando á veces la estructura vejetal. Sometidos á la calcinacion dan un carbon pulverulento de malas propiedades como combustible. Todos los lignitos se emplean para la combustion, pero son preferibles los mas compactos que se acercan mas á hullas. Su composicion, segun ha resultado de muchos análisis, es la siguiente.
Peso específico..................................... 1,24 á 1,36Muchos lignitos están acompañados de piritas de hierro, y en este caso el azufre produce el mismo mal efecto que en las hullas para emplearlo como combustible.
Carbon................................................. 63,8 72,0
Hidrógeno total..................................... 4,56 5,60
Hidrógeno libre..................................... 2,25 3,22
Oxígeno................................................ 16,12 21,28
Azoe.................................................... 1,5 2,0
Ceniza.................................................. 1,7 13,5
527. Azabache.
El lignito se encuentra á veces en masa compacta susceptible de tomar un escelente pulimento, y en este caso recibe el nombre de azabache.
528. Lignitos en España.
En las provincias de Zaragoza y Lérida, en Mequinenza y Granja de Escarp, se encuentran lignitos en una estension de 2 leguas formando capas de 3 y 4 pies de potencia; son bastante bituminosos, y su precio en la mina es 1 real quintal: se consume algo en las fábricas de Barcelona y el pais. En Alicante y Alcoy también se encuentran lignitos que se esplotan para el consumo de varias fábricas de paños y papel y algunas otras en Alcoy. En la provincia de Teruel hay lignitos en Utrillas, y se esplotan para destilar aguardientes, cocer cales y algún otro uso poco importante. En Asturias y algunos otros puntos se encuentran tambien lignitos, y azabaches en Careñas y otros sitios.
529. Potencia calorífica del lignito.
La potencia calorífica varia en los lignitos segun su clase y la cantidad de cenizas que contiene; pero si es aceptable como buen combustible, se podrá calcular por 6.200 unidades, rebajando este número cuando es de peor calidad.
530. Calor que radia el lignito.
Tomaremos como en los carbones y hullas la mitad del producido.
531. Antracitas.
La antracita se supone hulla antigua en la que los vegetales que la forman han llegado á su mayor estado de descomposicion. Es compacta, dura, no se aglomera por la calcinacion, y produce un carbon pulverulento y malo, arde con mucha dificultad, por cuya razon necesita estar en gran cantidad y bajo la influencia de una corriente de aire bastante viva. Se emplea como combustible en los Estados-Unidos, donde hay grandes criaderos debajo de los de hulla, y la usan en este pais, no solo en la industria sino en estufas de mucha corriente de aire para calentar las habitaciones. Los ingleses la emplean en pequeña cantidad, y también en Francia se emplea como combustible, pero en Europa el consumo es insignificante comparado con el de la hulla. La composicion, resultado de muchos análisis, es la siguiente.
Densidad........................................................ de 1,33 á 1,47
Carbon........................................................... 90,4 92,6
Hidrógeno total............................................... 2,43 4,2
Hidrógeno libre............................................... 2,09 3,96
Oxígeno......................................................... 0,5 1,62
Azoe.............................................................. 1,3 1,8
Ceniza............................................................ 0,9 4,7
532. Antracitas en España.
En España se encuentran antracitas en varios puntos, pero se esplotan poco; en la provincia de Oviedo, en Colungas, se esplota algo, y surte en Málaga unos hornos de fundicion.
533. Potencia calorífica de la antracita.
Pudiera tomarse mayor que la de las hullas, pues contiene mas carbono; pero como la práctica solo puede dar esta diferencia en cada caso segun la calidad, debe calcularse como la hulla en 7.500 unidades (501).
534. Calor que radia la antracita.
Para calor radiado por las antracitas se tomará, como en el carbon, la mitad del total producido.
535. Turbas.
Existen en la superficie de varios terrenos pantanosos ó que lo han sido, y tambien en los cauces de algunos rios, capas de vejetales mas ó menos descompuestas, que á veces están cubiertas con otra delgada de tierra ó arena, llegando á tener en algunos puntos estas capas vejetales un grueso de 10 ó 12 varas: en la parte superior presentan la forma de vejetales entrelazados, perdiéndose esta forma con la profundidad, de manera que en las capas gruesas se encuentra en el fondo una masa homogénea en la que por casualidad se distingue algun vejetal en su forma: á todas estas masas vejetales se da el nombre de turbas. Se ha supuesto que las turbas son el origen de todos los demás combustibles, y se concibe sin dificultad que, descompuestas por la accion del tiempo, den origen á los lignitos, que todavía mas descompuestos pierden completamente la forma vejetal para convertirse en hullas, las cuales pasan tambien por la accion del tiempo al estado de antracitas; comprueba tambien esta teoría la posicion que tienen todos estos combustibles respectivamente. Las turbas se emplean como combustibles, lo que es fácil concebir, puesto que se componen de vejetales; y para este uso se esplotan desecando los pantanos que las contienen, si es posible, ó estrayéndolas de su fondo por medio de dragas ó de otra manera: en todo caso se forman especies de ladrillos con moldes, y se hacen secar al sol. Este combustible retiene siempre por lo menos 25 por 100 de agua, á no ser que se haya secado en estufas; arde lentamente, y forma en general un humo espeso y de olor desagradable, por cuyas causas no es á propósito para muchos usos de la industria; pero sin embargo es combustible que se puede aplicar con ventaja en otros, como en la coccion de cal y ladrillo, y también en hogares para la produccion del vapor, pero es menester que se emplee en parajes donde el humo pueda esparcirse sin inconveniente. La composicion de las turbas es la misma que la de los otros combustibles semejantes, y solo varían las proporciones de los componentes. Varios análisis de turbas de buena calidad secadas en estufas han dado:
Carbon............................................. de 57 á 58En las turbas generalmente habrá que contar mucha mas ceniza que la indicada, pues á veces llega á 20 por 100; tambien el agua, como antes hemos dicho, suele llegar á 25 por 100 lo menos; de modo que este es el combustible que debe ensayarse siempre antes de usarse, determinando por medio de una desecacion á 60 ó 70 grados la cantidad de agua que contiene, y quemando despues bastante porcion, siquiera 2 ó 3 libras, para determinar la ceniza que produce. Es conveniente secar las turbas antes de hacer uso de ellas, por medio del calor perdido de algun hogar, siempre que sea posible, porque la turba seca arde mas pronto y desarrolla mas calor en menos tiempo, siendo tambien mayor el calor aprovechado.
Hidrógeno total................................. 5,60 6,12
Hidrógeno en esceso........................ 1,68 2,30
Oxígeno............................................ 28,96 29,80
Azoe................................................ 2 2,1
Ceniza............................................. 4,6 5,6
536. Turbas en España.
En España se encuentran turbas en muchos parajes, desde Toledo, junto á Navalucillos, que es el punto mas meridional donde se han encontrado, hasta la costa de Cantabria: hay turbas en la provincia de Madrid, en Chozas; tambien en la de Cuenca y Santander; en Oviedo se encuentran capas muy gruesas, y los fosos de Jijón están abiertos en una de 15 á 16 pies de potencia. No se esplotan en ninguna parte.
537. Potencia calorífica de las turbas.
La potencia calorífica es muy variable en las turbas segun su calidad, pero resulta de esperimentos hechos, que si tiene 10 por 100 de ceniza y 20 á 25 de agua, puede tomarse la potencia de la madera, ó sea 2.800 unidades por kilogramo, aumentando ó disminuyendo este número con la calidad. Si está secada en estufas podrá producir, no teniendo mucha ceniza, 3.800 unidades, y acaso mas si es buena.
538. Calor que radia la turba.
Segun esperimentos hechos, el calor radiado puede tomarse tambien igual al de la madera, esto es, la cuarta parte del producido.
539. Carbon de turba.
Las turbas carbonizadas pueden emplearse para los mismos usos que los carbones, y efectivamente se emplean hasta en la fabricacion del hierro en los altos hornos. El carbon de buenas turbas resulta compacto, arde con mas dificultad que el de madera, y generalmente tiene mas ceniza que este. La carbonizacion se hace en el campo, lo mismo que la de la madera (508), ó en hornos. El primer método es mas sencillo; las pilas forman grietas por sí, que dan entrada al aire, pero esto hace perder mucho carbon; sin embargo, con buenos obreros puede emplearse este método de carbonizacion. Cuando se quema en hornos, se construyen cilindricos y altos. Se enciende la turba por la parte inferior, y se cuida de no dar entrada mas que al aire preciso para carbonizar. Indicaremos un método de carbonizacion en hornos que produce buen resultado en carbon, y es muy económico. Un horno cilindrico A (fig. 250) se llena de turba por la parte superior B, cerrando despues esta parte con una plancha de hierro; éste horno, formado de ladrillo ó hierro, tiene una cavidad C en toda la estension de su parte esterior, la cual recibe los productos de la combustion de un hogar D, del cual salen primero á un canal H. desde donde pasan á C repartidos y luego marchan por B, saliendo los gases de la turba por L; en el hogar se queman turbas de mala calidad, y la carbonizacion dura 24 horas, al cabo do las cuales se abre el registro E y todo el carbon cae á un espacio cerrado en la parte inferior, donde se apaga mientras el horno se carga de nuevo. Por este método se obtiene 35 á 40 por 100 de carbon, pero hay que contar que para la carbonizacion se emplea en el hogar una cantidad de turba igual por lo menos al 35 por 100 de la introducida en el horno, lo que reduce el carbon producido á 26 ó 30 de la turba empleada total; en este carbon se encuentra además la ceniza que contenia la turba, de manera que muchas veces tiene el carbon, aun de turbas regulares de 18 á 20 por 100 de cenizas. En un horno semejante al que hemos descrito pueden carbonizarse turbas con el calor perdido de otro hogar, sin mas que suprimir el D y hacer llegar el humo caliente al canal H, en tal caso produce mas carbon con relacion al combustible empleado, y puede ser ventajoso fabricarle, sobre todo donde no hay otro combustible.
540. Potencia calorífica del carbon de turba.
La potencia calorífica del carbon de turba es muy variable, porque lo es tambien la cantidad de ceniza que contiene; pero segun esperimentos hechos con carbones que contenían hasta 18 por 100 de ceniza, se ha visto que puede fijarse en 5.800 unidades, aumentando ó disminuyendo este número si la cantidad de ceniza varía.
541. Calor que radia el carbon de turba.
Puede fijarse como en el carbon de madera en la mitad del producido.
542. Casca de tenería.
La casca de tenería, que es la parte leñosa de la corteza de encina, así como los restos de las maderas tintóreas, pueden aprovecharse como combustibles; las cascas, por ser abundantes, se emplean en algunos países, y también en España, como combustible en la economía doméstica, a causado su bajo precio. Suele moldarse la casca húmeda como los ladrillos, pero en forma circular de un diámetro de 4 á 6 pulgadas; estos discos se secan al aire, y aunque siempre retienen 25 á 30 por 100 de agua, pueden servir para todos los usos en que es aplicable un combustible que arde lentamente, y que no produce de pronto un calor vivo, pero que es suficiente para la formacion del vapor, á lo que hemos visto aplicado mas de una vez este combustible. La cantidad de ceniza que deja es grande, pues ya sabemos (503) que la corteza de la madera es la parte que mas produce; por esto se puede contar 10 á 12 por 100 en general.
543. Potencia calorífica de la casca.
La potencia calorífica de este combustible es corta, como puede deducirse por las propiedades que de él hemos indicado; segun varios esperimentos es menor que la de las turbas, y puede solo contarse que produce 2.300 unidades por kilogramo en el estado que suele encontrarse cuando se ha secado al aire.
544. Calor radiado por la casca.
El calor que radia podrá contarse, como el de la madera, la cuarta parte del producido.
545. Volumen de aire necesario para la combustion.
Tratándose de quemar una cantidad de combustibles, es necesario determinar la cantidad de oxígeno que necesita para arder, ó mas bien la cantidad de aire en que está contenido este oxígeno, que es de donde le toma el combustible. Pudiera creerse que no es necesario cálculo, pues haciendo entrar un esceso de aire, la combustion será completa; pero téngase presente que este aire se calienta á espensas del combustible, por lo que si entra en esceso llevará mucho calor que será completamente perdido; es, segun esto, necesario el cálculo para que no falte aire y la combustion sea completa, pero tambien para que un esceso no haga perder calor. El oxígeno convierte el carbono en ácido carbónico y el hidrógeno en agua (504); luego sabiendo cuanto carbono contiene un combustible, por la composicion del ácido carbónico, sabremos cuanto oxígeno necesita para formar el ácido, y sabiendo igualmente el hidrógeno, conoceremos el oxígeno necesario para formar agua. Ocupémonos del carbono. El ácido carbónico está formado en peso de 27,36 de carbono y 72,64 de oxígeno; luego suponiendo que sean estas partes kilogramos, tendremos que si 27k,36 de carbono necesitan 72k,64 de oxígeno, 1 kilogramo de carbono necesitará 27,36 : 72,64 : : 1 : x = 72,64 : 27,36 = 2k, 65: cantidad necesaria para convertir un kilogramo de carbono en ácido carbónico; pero como el oxígeno lo hemos de tomar del aire y este ha de calcularse en volumen, es necesario saber la cantidad 2k,65 de oxígeno qué volumen ocupa; sabido el peso de 1 metro cúbico de aire y la densidad del oxígeno, pudiéramos calcular el peso del metro cúbico de oxígeno, pero en la tabla (255) encontramos este peso calculado, pues el de 1 litro en gramos será el mismo que el de 1 metro cúbico en kilogramos: por tanto tenemos que 1 metro cúbico de oxígeno pesa 1k,4323; pero como nos han resultado 2k, 65 para 1 kilogramo de carbono, tendremos que si 1k,4323 es el peso del metro cúbico, 2k,65 serán el peso de los metros que dé la siguiente proporción, 1,43 : 1 : : 2,65 : x = 3,65 : 1,4323 = 1m,85, esto es, que 1 kilogramo de carbono necesita para arder 1,85 metro cúbico de oxígeno puro. El oxígeno se toma del aire, y falta determinar en qué cantidad se hallará contenido: para esto conocemos la composicion del aire en volumen (223), que tomaremos 21 de oxígeno en 100 partes, de modo que suponiendo sean metros cúbicos tendremos que si 21 metros cúbicos están en 100 partes de aire, 1,85 metros cúbicos estarán en 21 : 100 : : 1,85 : x = 8m,81 de aire; resulta pues, que 1 kilógramo de carbono consume para arder el oxígeno contenido en 8,81 metros cúbicos de aire: en estos cálculos no se puede tener en cuenta ni la presion ni la temperatura, que varían á cada momento. Un cálculo igual nos dará que 1 kilogramo de hidrógeno necesita 26,66 metros cúbicos de oxígeno, sabiendo la composicion del agua (157). Las cantidades de aire que han resultado son las que dan el oxígeno necesario, suponiendo que todo el del aire se emplea en la combustion; pero en ningun hogar pierde el aire su oxígeno completamente, y por tanto es necesario aumentar las cantidades calculadas. Un gran número de observaciones hechas para saber la cantidad de oxígeno que lleva el aire despues de la combustion, han dado que cuando el combustible es madera sale libre la tercera parte de oxígeno que entró, y si es otro combustible sale la mitad; de aquí resulta que la cantidad calculada ha de aumentarse añadiéndola su mitad si es para madera, y duplicándola cuando sea otro combustible; y no deberá hacerse entrar menos aire á pesar del calor que se llevará, porque 1 kilogramo de carbono reducido á ácido carbónico produce 7.200 unidades de calor (501), y reducido solo á óxido de carbono porque le falta oxígeno, se ha encontrado que produce solo 1.390; de donde resulta que si no entra bastante aire y una parte del carbono se convierte en óxido solamente, hay una perdida considerable de calor. Con los datos que acabamos de hallar podremos calcular la cantidad de aire que necesita un combustible de los que se emplean comunmente.
546. Cálculo para la hulla.
Como ejemplo del cálculo que hemos de hacer para determinar el aire que necesita un combustible, si ha de arder completamente, vamos á tomar la hulla, porque es el que tiene siempre carbono é hidrógeno. Supongamos que en ella hay 0,88 del primero y 0,05 de hidrógeno. Hemos visto (545) que 1 kil. de carbono necesita 8,81 metros cúbicos de aire para arder, luego 0,88 de carbono necesitará 1 : 8,81 : : 0,88 :x = 7m,75. Por igual razon tendremos para el hidrógeno 1 : 26,66 : : 0,05 : x = 1m,33; sumando estas dos cantidades, nos darán el aire necesario, que será 7,75 + 1,33 = 9m,08, y duplicando este número serán 18,16 metros cúbicos de aire los que deberán entrar en el hogar para que arda 1 kil. de hulla. Si fuera carbon ó madera que no tienen hidrógeno, el cálculo sería solo para quemar el carbon que contiene.
547. Tabla de la cantidad de aire que ha de entrar en el hogar por cada kil. de combustible.
Calculando (546) la cantidad de aire que necesita 1 kil. de diferentes combustibles para arder completamente, se han encontrado los números siguientes en metros cúbicos.
Madera seca........................................................ 6,75
Madera comun, 20 á 25 de agua.......................... 6,1l
Carbon de madera............................................... 16,40
Hullas, lignitos, antracitas...................................... 18,10
Cok.................................................................... 15,00
Turbas secas........................................................ 11,28
Turbas comunes, 20 á 25 de agua......................... 9,02
Carbon de turba................................................... 13,20
548. Volumen de gas que resulta de la combustion.
El aire al salir por la chimenea no tiene el mismo volumen que cuando entró en el hogar, pues aunque el acido carbónico formado tiene el mismo volumen que el oxígeno que entra en su formacion, y por esta causa no hay aumento, se dilata sin embargo por la temperatura; ademas en los combustibles que tienen agua, ésta forma vapor aumentando el volumen del gas que sale, y en los que tienen hidrógeno libre se forma tambien agua con el oxígeno y sale en estado de vapor, siendo en este caso su volumen mayor que el del oxígeno que le formó. Para conocer el volumen del vapor que se forma, calculemos el que produce 1 kil. de agua: sabemos que 1 volumen de agua da 1.685,89 de vapor á 100 grados (440); luego 1 kil., cuyo volumen es 1 decímetro cúbico, dará 1.685,89 decímetros cúbicos, ó sea 1m,68589: este volumen reducido (371) al que corresponde á la temperatura de 0 grados, será 1,68589 : (1 + 0,00367 x 100) = 1m,23: calculemos ahora la cantidad de vapor producido por el agua que contiene el combustible, sea de composicion ó higrométrica. Tomemos la madera y contemos 0,36 de agua de composición y 0,24 de higrométrica (503); tendremos que si 1 kil.de agua se convierte en 1m,23 de vapor, 0,36 + 0,24 = 0,60 se convertirán en 1 : 1,23 : : 0,60 : x = 0,74, de modo que por cada kil. de madera hay que aumentar 0,74 al aire que ha entrado para tener el que sale por haberse mezclado con el vapor. Si es combustible que tiene hidrógeno libre, calcularemos la cantidad de agua que forma y el vapor que este agua produce, pero se habrá de restar del volumen del vapor el del oxígeno que contiene, puesto que se encontraba en el aire que entró para la combustion. Supongamos un combustible que tiene 0,03 de hidrógeno: sabemos (157) la composicion del agua en peso; luego si para 11,11 de hidrógeno se necesitan 88,89 de oxígeno, para 0,03 se necesitarán 11,11 : 88,89 : : 0,03 : x = 0,24: esta cantidad con la de hidrógeno forman o,24 + 0,03 = 0,27 de agua, que si suponemos proviene de 1 kil. de combustible será 0k,27; convertida en vapor, segun antes hemos dicho, dará 0,27 x 1m,23 = 0,332, pero de este volumen hay que restar el del oxígeno tomado del aire que entró para la combustion, y para calcular este volumen tenemos (255) que si 1m,4323 de oxígeno es 1 litro, ó lo que es lo mismo 1k,4323 es 1 metro cúbico, 0k,24 de oxígeno será 1,4323 : 1 : : 0,24 : x = 0m,168, y restando este volumen del que ha resultado de vapor, será 0,332 — 0,168 = 0m,154, que es el aumento que tendrá por kil. de combustible el aire que entre en el hogar con el de vapor del agua, que formarán los 0,03 de hidrógeno libre. De este modo se han calculado las cantidades de gas á la temperatura de 0, que resultan de quemar 1 kil. de los diferentes combustibles, y se indican en la siguiente tabla; debiendo tenerse presente que cuando no contienen agua ó hidrógeno libre no hay vapor que aumente el aire que entra en el hogar.
Aumento por el vapor.
Gas que resulta despues de la combustion.
Madera seca.
0,59
7,34
Madera comun, 20 á 25 por 100 de agua.
0,74
6,85
Carbon de madera.
«
16,40
Hullas, lignitos, antracitas.
0,34
18,44
Cok.
«
15,00
Turba seca.
0,48
11,76
Turba comun, 20 á 25 por 100 de agua.
0,63
9,65
Carbon de turba.
«
13,20
Hemos supuesto los gases que resultan de la combustion á la temperatura de 0, y es evidente que saliendo á otra temperatura mucho mas elevada tendrán un volumen mayor, de modo que será necesario reducir á este volumen la cantidad total de gases que se haya calculado; como en ella tendremos aire y ácido carbónico, podremos tomar un coeficiente medio de dilacion (365), ó sea 0,00367. Supongamos que se quiere saber el aire que saldrá de un hogar donde se han quemado 20 kil. de hulla, siendo la temperatura de este aire al salir 300º: en la tabla anterior encontramos que por cada kil. salen 18m,44, luego por los 20 saldrá 18,44 x 20 = 368m,8; pero este volumen sería á la temperatura de 0, y reduciéndole al que será á la de 300 grados (371) tendremos 368,8 x (1 + 0,00367 x 300) = 774m,48, que es el volumen de aire que resultaría de quemar los 20 kil. de hulla. Segun lo dicho, para saber el volumen de aire que resulta de quemar una cantidad de combustible, tomaremos en la tabla anterior el número que corresponde á este combustible, le multiplicaremos por el número de kil., y el producto le reduciremos al volumen que debe tener pasando de la temperatura 0 á la que le supongamos al salir.
549. Calor perdido por el aire.
Calculemos el calor que se lleva el aire al salir del hogar. Supongamos qne se quema leña, que da, segun hemos visto, 2.800 calorías por kil., y que necesita (547) para arder 6m,11, ó 6,11 x 1,3 = 8 kilogramos (225) por 1 de combustible; sea la temperatura del aire al entrar en el hogar 15º y al salir 300; habrá subido 300 — 15 = 285°: si fuera agua, tomaría por cada grado y kil. una caloría (360); luego 8 kil. para 285° tomarían 8 x 285 = 2.280 calorías, pero como es aire habrá tomado la cuarta parte (407), ó sea 2.280 : 4 = 570; la madera ha dado 2.800, luego el aire se ha llevado mas de la quinta parte del calor producido, pues 570 x 5 = 2.850: de aquí resulta que mas de la quinta parte del combustible se pierde para el efecto útil, y solo se emplea en calentar el aire que sale por la chimenea, dándole una fuerza asecnsional que es la que le hace salir. Hemos supuesto que el aire no se trasforma en el hogar y que no hay vapores producidos; si tuviéramos en cuenta todo esto, sería mayor la pérdida. Si repetimos un cálculo igual para otros combustibles encontraremos que se pierde tambien mayor cantidad, porque para la madera solo hemos calculado 1/3 mas de aire del que necesita para arder, y otros combustibles necesitan doble: suponiendo que sea hulla, que sale el aire de la chimenea á diferentes temperaturas, y que la cantidad de este que entra es tambien diferente, resultan los números siguientes para cantidad de combustible perdido.
Temperatura de salida.
Aire esactamente necesario.
Doble cantidad de aire.
Triple cantidad de aire.
50º
0,021
0,043
0,063
100
0,043
0,086
0,123
200
0,086
0,172
0,252
300
0,129
0,258
0,378
400
0.172
0.344
0,506
500
0,215
0,430
0,630
Se ve por estos números que á 300°, entrando doble aire del que da el calculo, que es el que hemos visto debe entrar (545), el combustible perdido es mas de la cuarta parte; si entra triple aire se pierde mas de la tercera; por lo tanto estos números demuestran la necesidad de arreglar la entrada á la cantidad precisa para una buena combustion y nada mas.
550. Eleccion de combustible.
En la eleccion de combustible tendremos que examinar si puede dar la cantidad de calor necesaria sin perjudicar al efecto que se trata de producir; por esta causa se emplean carbones esclusivamente en muchos casos en lugar de emplear los combustibles de que se han sacado, y se desechan algunos por tener azufre, dar mal olor ú otras causas análogas. Elegidos los combustibles bajo este punto de vista, hay que examinarlos bajo el de la economía, y para esto tendremos presente el precio del combustible y el calor que produce, calculando cuánto cuesta una caloría de cada uno de ellos, y es evidente que será preferible el mas barato. Hay algunos casos en que no es el calor total el aprovechado sino solamente el radiado, y entonces el cálculo debe ser por una unidad de calor radiado y no del total. Comparemos en Madrid leña y hulla; contemos 1 quintal de leña a 12 rs. y 1 de hulla á 20; desde luego vemos que siendo mas que doble la potencia calorífica de la hulla y su precio menos de doble, hay ventaja por esta; pero si calculamos el precio de una caloría, contando 46 kil. por quintal, tendremos que 1 quintal de madera produce 46 x 2.800 = 128.000 calorías (501) y 1 de hulla 46 x 7.500 = 345.000; de modo que una caloría de la madera cuesta 12 : 128.800 = 0,000094, y una de la hulla 20 : 345.000 = 0,000058 de real: vemos que la ventaja está por la hulla. Supongamos que se ha de aprovechar solo el calor radiado; en este caso, como la madera radia la cuarta parte, será 128.800 : 4 = 32.200 el calor radiado por 1 quintal de madera y el coste de una caloría 12 : 32.200 = 0,00037: la hulla radia la mitad ó sea 345.000 : 2 = 172.500 unidades por quintal, y el coste de una caloría será 20 : 172.500 = 0,00012 rs., de modo que en este último caso, á un precio triple hay ventaja por la hulla Todos estos cálculos deberán hacerse despues de verificar los ensayos que se practiquen con los combustibles que se nos presenten, para determinar el agua y cenizas que contengan y su potencia calorífica, si puede ser.
"Manual de física general y aplicada á la agricultura y la industria" Eduardo Rodríguez
Ingeniero industrial; doctor en ciencias y ex-catedrático de la Universidad de Madrid; ingeniero químico de la Escuela Central de París; profesor de física general y aplicada en el Real Instituto Industrial
Madrid, 1858
Imprenta, fundición y librería de Don Eusebio Aguadó