|
Iniciació
a la bromatologia (pràctiques)
|
Protocols
d'anàlisi
|
Ref:8.4
|
|
ALCALINITAT
DE L'AIGUA
|
||
OBJECTE I FONAMENTS
Es tracta de determinar el
contingut de hidròxids, carbonats i bicarbonats presents a l'aigua.
Es fa una valoració amb una dissolució valorada d'un
àcid mineral fort, referida als punts d'equivalència corresponents
als ![]() i
i ![]() (pH=8'3,
corresponent a la zona de viratge de la fenolftaleïna) i del
(pH=8'3,
corresponent a la zona de viratge de la fenolftaleïna) i del ![]() (pH=4'5,
corresponent a la zona de viratge del taronja de metilè).
(pH=4'5,
corresponent a la zona de viratge del taronja de metilè).
En una mostra poden coexistir carbonats i bicarbonats junts ó
hidròxids i carbonats junts, però no hidròxid i bicarbonat.
Les reaccions a la valoració fins el viratge de la fenolftaleïna
són del tipus següent (el catió no té perquè
ser necessàriament sodi ni l'àcid titulant cal que sigui
necessàriament clorhídric):
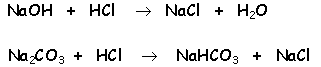
i, a partir d'aquí, i fins el viratge del taronja de metilè:
![]()
essent el bicarbonat reaccionant en aquesta fase el que tenia originàriament la mostra més el procedent de la transformació del carbonat a la fase anterior.
MATERIAL
Bureta de 50 ml.
Matrassos erlenmeyer de 250 ml.
Pipetes (el volum depèn del tipus de mostra).
REACTIUS
Àcid clorhídric
titulat 0'1N (o de normalitat menor).
Aigua destil·lada.
Fenolftaleïna al 0'5% en aigua/alcohol 1:1.
Taronja de metilè al 0'05% en aigua.
METODOLOGIA
1.- Prendre 100 ml de mostra
i transvasar a un erlenmeyer de 250 ml.
2.- Afegir dues gotes d'indicador de fenolftaleïna i valorar
fins desaparició del color (rosa a incolor).Anotar el volum consumit
(V1).
3.- Afegir dues gotes d'indicador de taronja de metilè i
continuar la valoració fins viratge (groc taronja a roig). Anotar
el volum total consumit (V2). Cas de que es presentin dificultats per
apreciar el canvi de color a les proximitats del punt d'equivalència,
bullir el matràs durant uns minuts, deixar refredar i continuar
la valoració.
4.- Fer un assaig en blanc amb aigua destil·lada i restar
dels valors del problema els obtinguts a l'assaig en blanc.
CÀLCULS
Els resultats s'expressen
en mil·liequivalents per litre d'aigua.
Si V2 = V1 (viratge immediat
del taronja de metilè), la mostra únicament conté
hidròxids.
Si V2 = 2•V1 la mostra
únicament conté carbonats.
Si V1 = 0 la mostra únicament conté
bicarbonats.
Si V1 = V2 = 0 la mostra
té alcalinitat negativa.
Si V2 > 2•V1 la
mostra conté carbonats i bicarbonats.
Si V2 < 2•V1 la mostra conté carbonats
i hidròxids.
Tenint en compte les consideracions
anteriors i anomenant:
VH al volum consumit d'àcid titulant corresponent
als hidròxids.
VC ídem pels carbonats.
VB ídem pels bicarbonats.
i que aquests volums són zero per aquells components inexistents, podrem calcular-los amb les expressions:
V1 = VC + VH
V2 - V1 = VC + VB
el contingut alcalí en mil·liequivalent/litre es calcula segons:
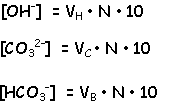
a on N és la normalitat de l'àcid titulant.
OBSERVACIONS
La normalitat de l'àcid
titulant estarà en funció del contingut alcalí de
la mostra.
Tots els reactius, així com l'aigua utilitzada a les dissolucions
i assaigs en blanc, cal que siguin de baix contingut en CO2.
El CO2 d'una mostra o d'una aigua destil·lada
pot eliminar-se mitjançant una reducció de pressió
per trompa de buit durant 15 minuts o per ebullició durant 15 minuts
(i deixant refredar en un ambient exempt de CO2).
Si l'alcalinitat de l'aigua és molt alta, prendrem una quantitat
de mostra inferior a 100 ml, (que dissoldrem amb aigua destil·lada
si el volum resultant és incòmode per la valoració).
En aquest cas, els càlculs seran:
![]()
essent X el resultat (de carbonats, hidròxids o bicarbonats, segons correspongui), V el volum consumit, en ml, de reactiu (VH, VC ó VB, segons correspongui) i v el volum de mostra en ml.
Qüestionari 8.4.- Alcalinitat de l'aigua
1.- Per què no poden coexistir a la mateixa mostra hidròxids forts i bicarbonats?
2.- Fer l'esquema gràfic del procediment analític.
3.- Deduir raonadament les fórmules utilitzades en els càlculs.
4.- Confeccionar el corresponent "butlletí d'anàlisi".