Els àcids són compostos que quan es dissolen en aigua s'ionitzen i originen ions H+, de manera que el pH de la dissolució és inferior a 7.
Hi ha dos tipus d'àcids:
-
Els hidràcids, combinacions binàries d'alguns no metalls amb l'hidrogen.
-
Els oxoàcids, combinacions ternàries de certs elements (principalment no metalls) amb hidrogen i oxigen.
- Són combinacions binàries de l'hidrogen amb els elements F,Cl, Br, I, S, Se i Te.
- L'hidrogen té estat d'oxidació +1 i el no metall té l'estat d'oxidació negatiu.
- No contenen oxigen.
- Formulació: HIDROGEN + NO METALL. L'hidrogen s'escriu a l'esquerra, abans del símbol del no metall: HF, HCl, HBr, HI, H2S, H2Se, H2Te.
- Nomenclatura:
- En estudiar les combinacions binàries de l'hidrogen, hem vist que aquests compostos s'anomenen arrel del nom del no metall -ur d'hidrogen. Aquesta nomenclatura s'utilitza quan estan en estat gasós.
- En canvi, quan estan en dissolució, s'anomenen àcid arrel del nom del no metall -hídric.
- Estat gasós: clorur d'hidrogen
- En dissolució: àcid clorhídric
H2S
- Estat gasós: sulfur d'hidrogen
- En dissolució: àcid sulfhídric
Dissociació dels hidràcids
- Quan estan en dissolució aquosa, els hidràcids perden els hidrògens en forma d'ions H+.
- Els hidràcids dels halògens (HF, HCl, HBr i HI) perden un catió hidrogen, mentre que els hidràcids H2S, H2Se i H2Te en poden perdre dos.
- Els anions resultants s'anomenen amb la
terminació -ur:
- F- ió fluorur
- Cl- ió clorur
- Br- ió bromur
- I- ió iodur
- S2- ió sulfur
- Se2- ió selenur
- Te2- ió tel·lurur
Més informació sobre els hidràcids: "Els hidrurs".
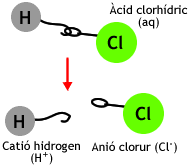
Dissociació de l'àcid clorhídric
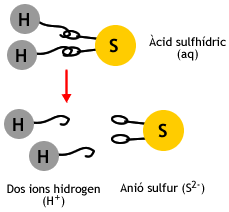
Dissociació
de l'àcid sulfhídric
Oxoàcids
- Tenen la fórmula general HaEbOc, on H és l'hidrogen, O l'oxigen i E un element no metàl·lic o algun metall (com el Mn o Cr). a, b i c són el nombre d'atoms de cada element.
- L'hidrogen té estat d'oxidació +1 i l'oxigen -2.
- L'element E té l'estat d'oxidació positiu.
- Estat d'oxidació de l'element:
per calcular-lo hem de tenir en compte que:
- l'hidrogen té estat d'oxidació +1
- l'oxigen té estat d'oxidació -2
- la suma de tots els nombres d'oxidació ha de ser zero a un compost neutre (sense càrrega).
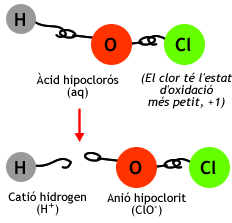
- Exemple: a l'oxoàcid HBrO2,
l'estat d'oxidació del brom és +3, ja que:
- El "nombre d'oxidació" de tots els oxígens és: 2 x (-2) = -4
- El "nombre d'oxidació" de l'hidrogen és +1.
- +1-4 = -3; per tant, perquè la suma total del compost sigui zero, el brom ha de tenir un estat d'oxidació de +3 (-3+3=0).
- Nomenclatura: per anomenar els oxoàcids
se sol utilitzar la nomenclatura tradicional.
- Element amb un sol nombre d'oxidació: àcid nom element -ic.
- Element amb dos nombres d'oxidació:
- Nombre d'oxidació menor: àcid nom element -ós.
- Nombre d'oxidació major: àcid nom element -ic.
- Element amb quatre nombres d'oxidació:
- Nombre d'oxidació menor: àcid hipo- nom element -ós.
- Segon nombre d'oxidació: àcid nom element -ós.
- Tercer nombre d'oxidació: àcid nom element -ic.
- Nombre d'oxidació major: àcid per- nom element -ic.
Els oxoàcids més importants:
| HClO | Àcid hipoclorós |
| HClO2 | Àcid clorós |
| HClO3 | Àcid clòric |
| HClO4 | Àcid perclòric |
| HBrO | Àcid hipobromós |
| HBrO2 | Àcid bromós |
| HBrO3 | Àcid bròmic |
| HBrO4 | Àcid perbròmic |
| HIO | Àcid hipoiodós |
| HIO3 | Àcid iòdic |
| HIO4 | Àcid periòdic |
| HMnO4 | Àcid permangànic |
| H2SO3 | Àcid sulfurós |
| H2SO4 | Àcid sulfúric |
| HNO2 | Àcid nitrós |
| HNO3 | Àcid nítric |
| H3PO4 | Àcid fosfòric |
| H2CO3 | Àcid carbònic |
Dissociació dels oxoàcids
- Quan estan en dissolució aquosa, els oxoàcids perden els hidrògens en forma d'ions H+.
- L'anió que es forma és poliatòmic, és a dir, està format per dos o més àtoms units de manera covalent.
- Els anions resultants s'anomenen amb les
terminacions:
- -it si l'àcid acabava en -ós.
- -at si l'àcid acabava en -ic.
- Si els àcids tenien el prefix hipo- o per-, els anions el conserven.
Més informació:
http://www.iesberenguer.net/departaments/fisicaiquimica/inorganica/apuntsino1.htm
![]() Material elaborat per Irene Martínez
Material elaborat per Irene Martínez
![]()

Aquesta obra està subjecta a una Llicència
de Creative Commons.