La valència d'un element és el nombre d'àtoms d'hidrogen que es combinen amb un àtom d'aquest element. L'electrongativitat és la tendència d'un àtom d'un element a atraure electrons quan es combina amb un altre.
Combinant aquests dos conceptes tenim el nombre d'oxidació d'un element, que pot representar diferents coses segons parlem d'ions i compostos iònics o de compostos covalents.
- Ions monoatòmics
- El nombre d'oxidació representa la seva càrrega, amb el signe corresponent.
- Exemple: Na+ té nombre d'oxidació +1; O2- té nombre d'oxidació -2.
- Compostos iònics
- El nombre d'oxidació representa la càrrega de cadascun dels ions que els formen.
- Exemple: el NaCl està format pels ions Na+, amb nombre d'oxidació +1, i Cl-, amb nombre d'oxidació -1.
- Compostos covalents
- El nombre d'oxidació representa el nombre de parells d'electrons que comparteixen.
- L'element més electronegatiu (que tindrà els electrons més a prop), té un nombre d'oxidació negatiu, i l'altre el tindrà positiu.
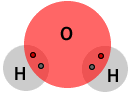
- Exemple: a l'aigua (H2O), cada hidrogen
comparteix un parell d'electrons amb l'oxigen.
Cada hidrogen, per tant, té nombre d'oxidació +1.
L'oxigen, en canvi, comparteix dos parells d'electrons, i com que és l'element més electronegatiu, té un nombre d'oxidació -2.
Nombres d'oxidació:
Li+,
Na+, K+,...
+1
Be2+,
Mg2+, Ca2+,...
+2
O2-,
S2-,...
-2
O:
-2
H:
+1
Fórmules i nombres d'oxidació
Quan es formen compostos, un dels elements té un nombre d'oxidació negatiu i l'altre (o altres) el tenen positiu.
Podem visualitzar el nombre d'oxidació com uns "gafets" que tenen els àtoms per unir-se entre sí. En combinar-se els àtoms per formar el compost, ho fan de manera que la suma dels nombres d'oxidació dels diferents elements sigui nul·la, és a dir, que no quedi cap gafet lliure.
Si representem els nombres d'oxidació positius amb gafets oberts i els negatius amb gafets tancats, els compostos anteriors es podrien visualitzar de la següent manera:
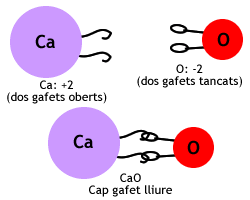
- Òxid de calci. El calci té nombre d'oxidació +2 i l'oxigen nombre d'oxidació -2. Per tant, n'hi ha prou amb un àtom de cada, i la fórmula resultant és CaO.
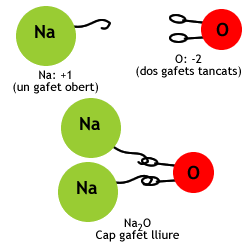
- Òxid de sodi: el sodi té nombre d'oxidació +1 i per tant seran necessaris dos àtoms de sodi per cada un d'oxigen, per la qual cosa la fórmula serà Na2O.
Més informació:
Estat
d'oxidació (la Viquipèdia)
Símbols
i valències
![]() Material elaborat per Irene Martínez
Material elaborat per Irene Martínez
![]()

Aquesta obra està subjecta a una Llicència
de Creative Commons.