Química 2n de Batxillerat, Crèdit 3, Unitat 1
2.- Primer principi de la termodinàmica.
L'energia no es crea ni es destrueix, per la qual cosa, en qualsevol procés termodinàmic, la quantitat total d'energia de l'univers es manté constant. La quantitat d'energia que conté qualsevol sistema s'anomena energia interna, U, i la seva variació DU es determina com la suma de la calor, Q, intercanviada entre els sistema i el seu entorn, i el treball, W, realitzat pel sistema a sobre seu:
U - U0 = DU = Q + W
El criteri de signes acceptat per conveni és el següent:
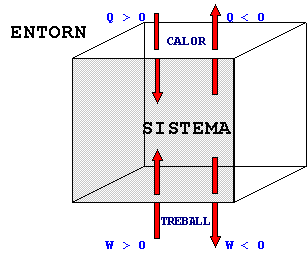 |
|
Així podem distingir els següents casos per als possibles intercanvis de calor (Q) i de treball (W) entre un sistema i el seu entorn si el sistema evoluciona des d'un estat inicial amb energia interna U0 fins a un estat final amb energia interna U:
| Si el sistema absorbeix calor i fa un treball | Si el sistema cedeix calor i es fa un treball a sobre |
| Com
que: Q>0 i W<0
si |Q|>|W| si |Q|<|W|
|
Com
que: Q<0 i W>0
si |Q|>|W| si |Q|<|W|
|
En la majoria de processos el treball realitzat és de tipus pressió-volum. Aquest treball es pot expressar en funció de la pressió (P) externa exercida sobre el sistema i de la variació de volum (DV) experimentada el sistema en estudi:
W = -P·DV
Aquesta expressió ens permet determinar el treball d'expansió on DV>0 i per tant W<0 i el treball de compressió on DV<0 i W>0.
Respecte d'aquest increment de volum (DV) cal tenir en compte que és únicament significatiu en processos on es troben implicats gasos, ja que els sòlids i líquids no experimenten pràcticament cap expansió, per la qual, cosa en un procés on es manté un d'aquests estats d'agregació la variació de volum és pràcticament nul·la i el treball negligible.
Autor: O. Castell