|
|
Formulació |
|
Imprimir
|
|
|
Principi |
||||
| Química I | ||||
| Química II | ||||
|
|
|||
|
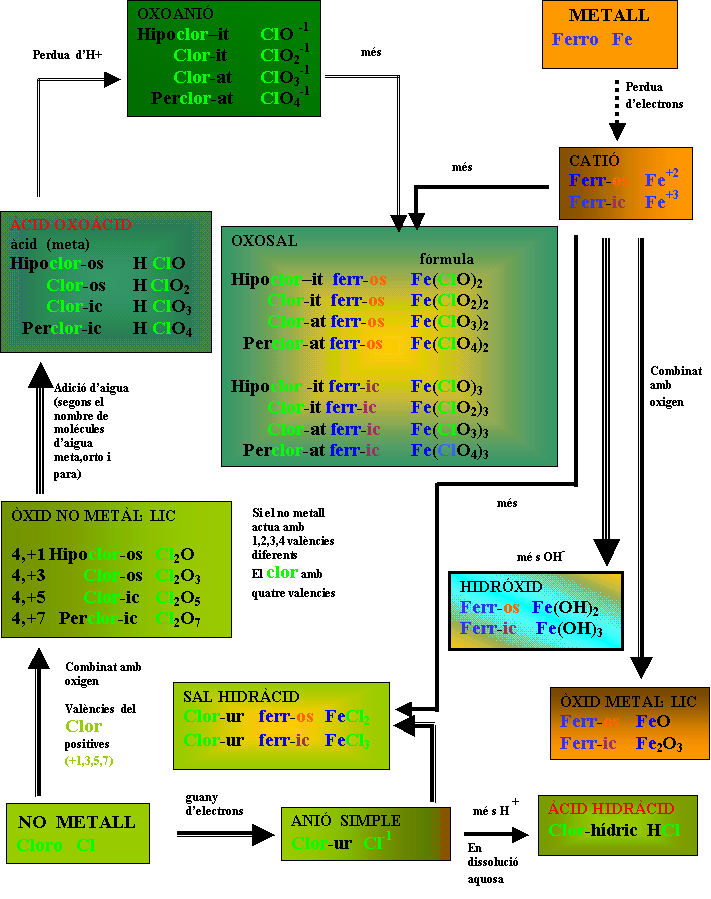
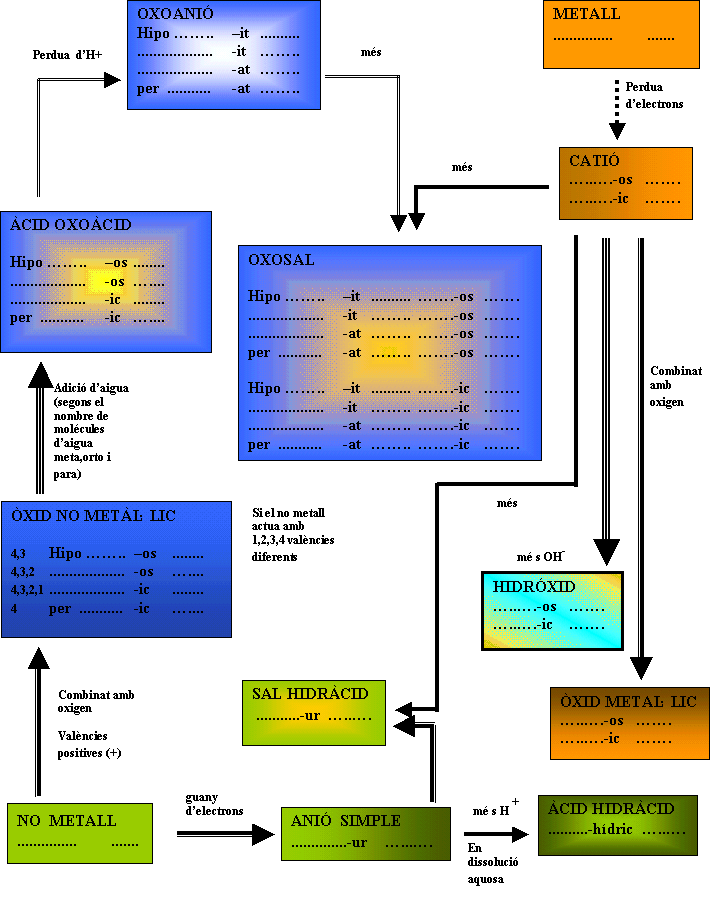
Nom. Stocks:Indica els elements que formen el compost (oxo,sulf,) i dóna la valència del element en números romans, s'assembla a la nomemclatura estequiométrica. |
||
|
NOMENCLATURA a) Metall - No Metall - (el no metall actua amb l'estat d'oxidació negatiu
- Preposició DE- Nom del Metall (menys electronegatiu) sense variació amb un prefix de quantitat com abans (MONO - ...) Nom. d'Stock: - Nom del no Metall acabat
en -UR - Preposició DE
entre parèntesis i en xifres
romanes. (...) Nom. tradicional: - Nom del no Metall acabat
en -UR - En lloc d'indicar I'estat d'oxidació del metall
s'utilitza el sufix: - -ÓS - Si és l'estat d'oxidació més baix. - -IC - Si és l 'estat d'oxidació més alt (si
només té un estat d'oxidació es posa : el sufix ·
Els compostos amb Oxígeno s'anomena
ÒXID ·
** Els compostos amb hidrogen s'anomena
HIDRUR - Nom del no Metall més electronegatiu amb el sufix -UR i un prefix que indiqui el nombre d'àtoms d'aquest element que
formen el compost. (MONO-,
DI-, TRI- ...) - Preposició DE - Nom del No Metall menys electronegatiu sense variació amb un prefix de quantitat com abans (MONO-,..)
Taula
de creixement de l’electronegativitat
Metalls B, Si , C , As , P, N, H ,Te , Se , S , I , Br , Cl , O , F
-Excepcions: - L'oxigen s'anomena ÒXID Nom. Stocks – ** També es poden anomenar utilitzant la nomenclatura d'Stocks
explicada en l'apartat a) HIPO- ......................... -ÓS
4, 3 Nombre d'estats d'oxidació
......................... -ÓS
4, 3,
2 .
......................... -IC
4, 3,
2, 1 PER-
......................... -IC
4 (Ex. el clor té 4
estats possible positius:+1+,3,+5,+7 Hipoclorós ,clorós, clòric i perclòric) (Un element amb 3 estat posibles tendria compostos: hipo... os,...os, ...ic) *Aquests compostos amb
oxigen en aquesta nomenclatura també
s'anomenen Anhídrids |
|||
|
Els peròxids: grup peroxo O22- número d'oxidació del oxigen: -2 (-O - O- ) 2- Nom. - S'anomenen de la mateixa
manera que els compostos Metall - No Metall.
hidròxids : grup hidroxil OH - nombre d'oxidació -1
cianurs :
grup ciano CN
- nombre d'oxidació -1
Nom. - S'anomenen de la mateixa
manera que els compostos : Metall - No Metall. - Aquets grups actuen com
el No metall |
||
|
(veure No metall - No metall apartat b)
compostos amb hidrogen)
Nom. Tradicional - La paraula ÀCID seguida del nom del no Metall acabat en -HÍDRIC.
b) Àcids Oxàcids: Hidrogen
+ ( No Metall +Oxigen )
Nom. Estequimètrica - Paraula ÀCID - Prefix que indiqui el nombre d'oxígens seguits de la paraula
-OXO- - Nom de l'element acabat en -
IC - Estat d'agregació del no metall en números
romans i entre parèntesis (...) *** També es poden anomenar
com a sals d'hidrògens.
Nom. Tradicional: Es convenient memoritzar : Els noms d'
Àcids de nomenclatura tradicional
admès són els següents:
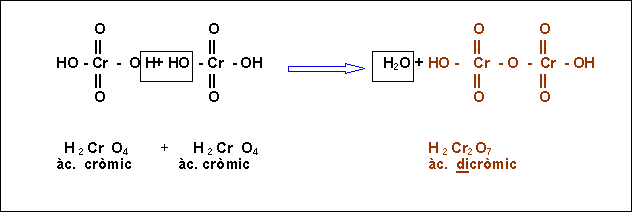
Exemple: Formació del àcid dicròmic per condensació de dues molècules de àcid cròmic i pèrdua de una molècula de aigua
Nomenclatura :-S’anteposa el prefix peroxo-
al nom de l'àcid del qual
procedeix Es formen estos compostos en sustituint en un oxoàcid,
una espècie O-2 (oxo) pel grup S-2 Nomenclatura : - S'anteposa el prefix
tio- al nom de l'àcid
del qual procedeix - S'indica amb els prefixos
di, tri,..... el nombre de
grups O-2 (oxo) que s'han
substituït Nom. Tradicional:-
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Nom. Estequiomètrica : - Es substitueix la paraula
àcid - Es canvia el sufix -ic
per –at - Preposició DE - S'anomena el Metall indicant el seu estat d'oxidació
en xifres romanes i entre parèntesis (...) Nom. Tradicional: - Canvia el sufix de l’ àcid ( terminació) Sufix-àcid
... -ós == canvia per ===>
sufix-sal ... -IT ...
-ic == canvia per ===> ...
-AT - seguit del nom del Metall
acabat en -OS o en -IC segons sigui la seva valència DISALS: Es formen en sustituint els hidrògens
d'un Diàcid per un catió
(metall) Nomenclatura: S'utilitza la mateixa que per les sals. SALS ÀCIDES: Na HC O3 hidrogencarbonat de
sodi Substitueix un hidrogen
al H2 C O3 Na 2 H P O4 dihidrogenfosfat de sodi. Substitueix dos hidrogens al H
3 P O4
|
||
|
Ca Zn O2 : dióxid (doble) de calci i zinc Be Ca (CO3)2 : dicarbonat
(doble) de beril·li i calci
|
||
|
Els complexos son especies químiques formades per un àtom central i diversos lligands, aquestes espècies químiques podens ser: cations, anios, neutres.
La agrupació complexa pot ser: positiva, neutra o negativa, i la seva càrrega és la suma de les càrregues de l'atom central i els lligands. Com Formular un complexe: Cal recordar com és l'estructura d'una formula quimica: D'esquerrra a dreta: primer els grups menys electronetgatius després els grups més electronegatius : Primer el catió i despres els anió:
Com Anomenar un complex:
Exemples Formular:
Anomenar [FeCl(H2O)5)]+2
[PtCl(NH3)3)] Cl
K3 [Ni(CN)5]
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(el
No metall no és ni Hidrogen ni Oxigen ) (el
No metall no és ni Hidrogen ni Oxigen )
|
||
|
II ) - Escala de electronegativitats
creixents
III ) - Nomenclatura més utilitzada : S’indica hombrellat amb gris ___________________________________ Metalls B,
Si , C , As , P, N, H ,Te
, Se , S , I , Br , Cl O
, F
Els Hidrurs metàl·lics Metalls B, Si ,
C , As , P, N, H T , Se , S , I , Br , Cl , O , F
___________________________________ Metalls B, Si ,
C , As , P, N, H Te
, Se , S , I , Br ,Cl O , F Sals hidràcids
* veure les sals d'àcids hidràcids ___________________________________ Metalls B, Si ,C ,As, P, N, H ,Te , Se , S , I , Br , Cl O , F
___________________________________ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Metalls
B, Si , C , As , P, N, H Te,
Se, S ,I , Br ,Cl
O , F
Hidrurs No Metàl·lics
(Àcids hidràcids)
___________________________________ Metalls B, Si ,C , As , P, N H Te , Se , S , I , Br , Cl O , F
Altres hidrurs
___________________________________ Metalls B, Si ,C , As , P, N, H ,Te , Se , S , I , Br ,Cl O , F
Els òxids No metàl·lics
___________________________________ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
___________________________________ Metalls
grup O H
H grup
( no metall + oxigen ) Els àcids oxoàcids
Metalls grup ( no metall+oxigen )
Oxosals
* Es sustituexen tots els hidrogen del oxoàcid
per un metall ___________________________________ Metalls grup
[ H + ( no metall + oxigen )] Sals
àcides
* Solament poden tenir sals àcides els àcids
que tinguin més de un hidrogen * Per anomenar una sal àcida amb dos o més
hidrògens es posen els sufixos Di,Tri..hidrogen.. ___________________________________
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
 |
|
|
Formula general : Cn H2n+2 a) Alcans
lineals no ramificats: Metà CH4 ....................... CH4 Età C2H6..................... CH3- CH3 Propà C3H8 .................... CH3- CH2 - CH3 Butà C4H10.................... CH3- CH2
- CH2 - CH2 Pentà CH5H12................. CH3- CH2
- CH2 - CH2 - CH3 DECÀ C10H22.................. CH3-CH2-CH2
-CH2 -CH2-CH2-CH2-CH2-CH2-CH3 Undecà C11H24 Dodecà C12H26 Eicosà C20H42 Triacontà. C30H62 Tetracontà C40H82 Hectà C100H102
b)Alcans de
cadena ramificada:
RADICAL: Hidrocarbur que ha perdut un hidrogen i pot combinar-se amb un altre hidrocarbur. S’anomena amb la mateixa arrel del hidrocarbur del qual procedeix i la terminació -il Metil CH3- Etil CH3- CH2- Propil CH3-
CH2 - CH2 Butil CH3- CH2 - CH2
- CH2 2 - En cas que hi hagi dues cadenes amb igual nombre de carbonis, es pren com a cadena principal la que té més substituents o radicals.
5 - En cas de tenir la cadena principal triada, dos substituents diferents ocupant posicions tal que, tant si es comença a numerar per un extrem com per l'altre, els nombres que corresponen als carbonis que estan units a aquests substituents són els mateixos, s'atribueix el nombre més baix al carboni unit al substituent que s'ha de citar primer per ordre alfabètic.
7- En la nomenclatura d'un hidrocarbur, els números que indiquen la posició dels substituents s'han de separar sempre amb comes i els números dels noms amb guionets. Radicals
complexos : Noms sistemàtics d'alguns radicals complexos:
HIDROCARBURS INSATURATS ALQUENS: .Davant el nom de la cadena mes llarga triada es posa el nombre del carbo on es troba el doble enllaç Si n'hi ha dos enllaços dobles es posen els nombres dels carbons on es troben davant el nom corresponent a la cadena mes llarga en la qual es trobe aquest dobles enllaços amb la terminació -dieno ALQUINS: Per formular un hidrocarbur insaturat i ramificat: - La cadena principal d'un hidrocarbur
insaturat i ramificat: - Té el màxim número de insaturacions
-
És la cadena més llarga - Hi tenen prioritat els dobles enllaços
sobre els triples en igualtat de condicions Per numerar un hidrocarbur cíclic, tenen prioritat els enllaços múltiples sobre els radicals alquilics.
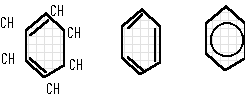
- L'hidrocarbur aromàtic més senzill és el benzè: C6 H6 - Els
substituents sobre l'anell benzénic s'anomenen com a radicals del benzil.
-
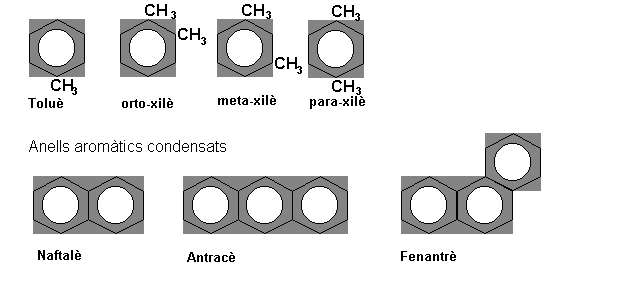
Noms comuns d'alguns arens
(per ordre de prioritat ascendent)
ORDEN DE PRIORITATS
El grup funional prioritati numera els carbons de la cadena principal i es posa com sufix, la resta de grups es possen com prefixes. Exemple : àcid 2,3-dibromo-4hidroxi-pentanoic
NOMENCLATURA 1- Substàncies amb un sol grup funcional: La cadena principal d'un compost amb un
grup funcional: - La que té el grup funcional. La
més insaturada - La més llarga
2- Substàncies amb diferents grups funcional: - Es tria el grup funcional principal segons
la taula. - La cadena principal és la que té més grups
funcional principal. -
S'anomena amb el sufix del grup funcional principal. Els altres grup funcional s'anomenen amb els sufixos indicats a
la taula.
--------------------------------------------
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||