Les substàncies acolorides absorbeixen radiació de la banda
visible de l'espectre. L'absorció d'energia provoca canvis en els
nivells electrònics, fent que els electrons saltin dels
nivells fonamentals a nivells superiors excitats.
Els electrons excitats són els dels nivells superiors, els mateixos que participen en els enllaços químics o els que es queden formant parells no enllaçats. Els electrons més interns romanen fortament atrets per el nucli positiu de l'àtom. L'energia necessària per excitar aquest últims electrons és molt gran.
La llum visible no és la causa de tots els salts electrònics. Molts requereixen valors més elevats d'energia que corresponen a la banda de la radiació ultraviolada En aquest cas, encara que els compost absorbeixi els U.V. el veurem incolor.
L'energia que cal per excitar un electró en un compost acolorit i en un compost incolor. Aquesta energia s'anomena energia d'excitació.
Compostos acolorits
1.-
Els compostos orgànics
acolorits, gairebé sempre, tenen algun grup - C = C -, - C = O
o - N = N -. Generalment aquests grups formen part d'un conjunt d'enllaços
amb electrons deslocalitzats, anomenat cromòfor. Els electrons
dels enllaços dobles requereixen menys energia d'excitació
que els electrons dels enllaços simples, en particular quan el
doble enllaç forma part d'un sistema conjugat. La menor energia
d'excitació implica que aquests compostos absorbeixen la llum visible.
Els grups funcionals com - OH, - NH2 o - NR2 , que es troben molt sovint
units a grups cromòfors, realcen o modifiquen el color de les molècules.
Tots aquests grups contenen parells d'electrons lliures que s’integren
en el sistema d'electrons deslocalitzats. Petits canvis en el sistema
d'enllaços amb electrons deslocalitzats poden fer canviar l'energia
de la radiació que la molècula absorbeix i en conseqüència
el color del compost també canvia.
Les molècules de colorant solen tenir un color diferent segons
es trobin en dissolució àcida o en dissolució alcalina.
Aquests tipus de compostos poden ser emprats com a indicadors àcid-base.
Per exemple, el taronja de metil és roig en dissolucions àcides
de pH inferior a 3,5. Per sobre d’aquest valor del pH, les seves
dissolucions són grogues. En la forma vermella, un dels àtoms
de N té un H+ unit a ell de manera que l'energia que absorbeix
el sistema d'electrons deslocalitzats canvia respecte a la que absorbeix
la forma groga:
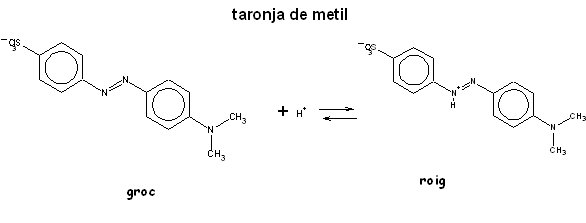
2.-
Compostos inorgànics acolorits
Els compostos inorgànics contenen quasi sempre metalls de transició
i són acolorits, tant en estat sòlid com en dissolució.
Un àtom només absorbeix la llum si l'energia de la radiació
lluminosa coincideix amb la diferència d'energies entre dos dels
seus nivells electrònics. Quan es dona aquesta coincidència,
un electró salta des de l'orbital de més baixa energia al
d'energia superior. De manera que l'àtom o l'ió que absorbeix
la radiació lluminosa canvia des de l'estat fonamental a l'estat
excitat.
Quan es tracta d'un ió metàl•lic en fase gasosa, els
cinc orbitals d tenen el mateix nivell d’energia. En un complex,
el metall està voltat per lligands negatius o per molècules
polars amb parells d'electrons solitaris. La presència d'aquests
lligands afecta als electrons dels orbitals d de l'ió metàl•lic
central i modifica els seus nivells d’energia. Els cinc orbitals
d, degut als lligands, ja no tenen el mateix nivell d’energia i
s'escindeixen en dos nivells.
Quan la llum travessa una dissolució amb ions [Ti(H2O)6]3+, es pot absorbir un fotó.
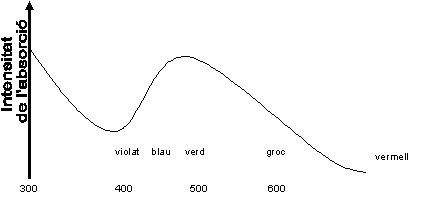
Espectre d'absorció de l'ió hidratat [Ti(H2O)6]3+.
L'ió [Ti(H2O)6]3+ no és més que un senzill exemple, doncs només conté un únic electró d. La situació és més complicada quan hi més d’un electró d i són possibles més salts entre els nivells electrònics. No obstant això, el principi és el mateix.
L’energia que cal per excitar un electró d a un nivell d’energia més alt també depèn de l’estat d’oxidació del metall. És per això que en les reaccions redox dels compostos de metalls de transició hi ha canvis de color espectaculars. Per exemple, el vanadi en dissolució aquosa mostra un color diferent per a cada estat d’oxidació.
V(+5) groc --> V(+4) blau --> V(+3) verd --> V(+2) violat
El color d'un complex d'un metall de transició depèn dels factors següents:
• El nombre d'electrons d present en l'ió del metall de transició.
• La disposició dels lligands entorn de l'ió, degut a que afecta a la separació entre els orbitals d.
• La naturalesa dels lligands, de manera que els lligands diferents tenen un efecte diferent en l'energia dels orbitals d en un ió determinat.
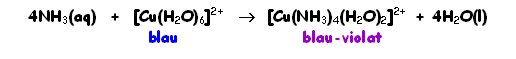
Alguns lligands tenen un efecte més potent que altres en la separació dels nivells d’energia dels orbitals. El canvi del tipus de lligand que es coordina al metall de transició fa que canviï el color del complex que es forma. Per exemple, els lligands NH3, provoquen una escissió entre els orbitals d més gran que els lligands H2O. Per exemple, el color blau dels ions hidratats Cu2+ canvia blau-violat quan s'afegeix NH3. En el cas de l'ió complex, els lligands amino són els causants d'una separació més gran entre els nivells d'energia dels orbitals d. La qual cosa té com a conseqüència que s'absorbeixi llum de menor longitud d'ona.
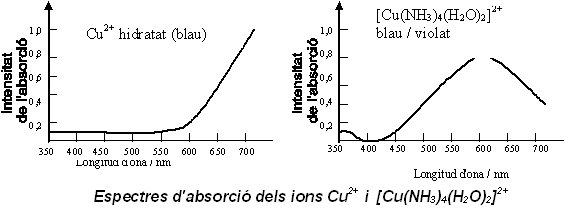
A més, el color dels complexos depèn també de com estan col•locats els lligands entorn de l'ió metàl•lic central, és a dir de la simetria. Fins i tot es troben isòmers geomètrics de colors diferents.
A vegades l'absorció de llum visible pot causar la transferència d’un electró des del nivell fonamental a un nivell superior d’un altre àtom adjacent. Aquest fenomen és un tipus de transició electrònica molt particular que s’anomena pròpiament transferència electrònica. Aquest tipus de transició és la causa de la brillantor especial d'alguns pigments acolorits com el "groc de crom" o el "blau de Prússia".
Alguns ions del bloc d són incolors per la impossibilitat que els electrons saltin entre els nivells d. Aquest és el cas del Zn2+, que té els 5 orbitals 3d totalment ocupats per 10 electrons. Per això els compostos de Zn2+ són blancs.
Química SALTERS