Les mescles homogènies o dissolucions
Les mescles
homogènies tenen un aspete uniforme, és a dir quasevol porció té la
mateixa composició i propietats. A les mescles homogènies els components
no es poden distingir ni amb l'ajut d'un microscopi electrònic, que són
els més potents
Les mescles homogènies també reben el nom de dissolucions. En funció
de l'estat físic de la mescla, les dissolucions poden ser gasoses, líquides
o sòlides.
- Dissolucions gasoses: formades per un conjunt de gasos com
és el cas de l'atmosfera que està feta d'un
71% de nitrogen, un 21 % d' oxigen i un 1% d'altres gasos.
- Dissolucions sòlides o aliatges: als aliatges es troben mesclats
en diferents proporcions dos o més metalls. La preparació d'aquests
aliatges es duu a terme fonen els metalls. Després es barrejen
en la proporció adequada i es deixen solidificar. Tipus d'aliatges:
- Bronze: El bronze es conegut des de la prehistòria.
Es tracta d'una mescla de coure amb estany. A l'antiguitat s'utilitzaba
per fabricar objectes domestics, armes i escultures.

Escultura feta en bronze
- Llautó: aquest aliatge és una mescla de coure amb zinc.
S'utilitza en objectes de decoració. Té una gran resistènica a la
corrosió (desgast lent d'un material).
- Acer: aliatge d'una gran utilització actualment. Es una
mescla de ferro amb una petita proporció de carboni. S'utilitzen
a tot tipus de maquinària i instruments ( turbines, carrosseries,
coberteries, etc). Un tipus d'acer molt conegut és el inoxidable,
als quals se'ls afegeix a més de ferro i carboni, crom i niquel.
Un altre tipus d'aliatges de ferro i carboni és el ferro colat,
amb una major proporció de carboni. El ferro colat s'utilitza per
fer peces de disseny complicat.
- Dissolucions líquides: les més conegudes són les que mesclen
l'aigua, conegudes amb el nom de dissolucions aquoses
. L'aigua es pot mesclar amb gasos (com l'oxigen), líquids (com l'alcohol)
i sòlids (com la sal comuna).
En una dissolució líquida, el component majoritari s'anomena dissolvent
i el component minoritari s'anomena solut. En aquestes dissolucions
les propietats físiques , com ara la densitat o el punt de congelació
del dissolvent varien. Per exemple, en una dissolució d'aigua amb sal
el punt de congelació és inferior al de l'aigua pura, que congela als
0º.
Concentració d'una dissolució
Si mesclem aigua amb sal podem optar per afegir molta o poca sal.
Quan les comparem, podem dir que la dissolució a la que hem
afegit més sal està més concentrada que la segona. També
podem dir que la segona, a la que hem afegit menys sal està més diluïda
que la primera. Però què passa quan continuem afegint
sal? Arribarà un moment que el dissolvent (l'aigua) no podrà
admetre més sal. Llavors l'excés de sal es dipositarà
al fons del recipient. La dissolució està saturada
Càlcul de la concentració d'una dissolució
La concentració d'una dissolució és igual a
la quantitat de solut que hi ha dissolt en una determinada quantitat
de dissolució. La fòrmula general és:
| concentració= |
| quantitat de solut |
| quantitat de dissolvent |
Hi ha dos maneres d'aplicar està fòrmula, ja que la concentració d'una
dissolució es pot expressar o en tant per cent en pes o en gram/litre:
| % en pes= |
| grams de solut * 100 |
| grams de dissolvent |
| grams/litre = |
| grams de solut |
| litres de dissolució |
Així per exemple, si tenim una dissolució de 20 grams de alcohol en
500 cm3 d'aigua, quina és la concentració en % en pes i en
grams/litre? ( S'ha de recordar que un cm3 d'aigua equival
a un gram d'aigua).
| % en pes = |
20 gr. alcohol *100 |
= 4 % d'alcohol |
| 500 gr. aigua |
| grams/litre = |
20 gr. alcohol |
= 0.04 grams alcohol/litre
d'aigua |
|
0.5 litres d'aigua |
Separant mescles homogènies
A la Natura es fa molt difícil trobar substàncies pures ja que tant
la matèria orgànica com l'inorgànica es troben molt mesclades. Tanmateix,
l'indústria necessita treballar amb substàncies pures. Per obtenir-les
cal separar els components que formen una mescla. En funció dels components d'una mescla
homogènia que vulguem separar hi ha
diferents tècniques:
-
Separant sòlids de líquids: l'objectiu és que un component canviï d'estat i l'altre es queda igual.
La tècnica més emprada és la cristalització. És el pas invers a dissoldre un sòlid dintre d'un dissolvent
. Es deixa que el dissolvent s'evapori per quedar-nos només amb el solut. Amb aquesta tècnica es separa la sal de l'aigua
a les salines: és deixa evaporar l'aigua en unes grans picines i després es recull la sal que ha cristalitzat.
- La destil.lació: amb aquesta tècnica es separan els components d'una dissolució
gràcies a que cada component té un punt d'ebullició diferent. La dissolucó es escalfada, llavors el primer component que s'evapora
pasa a un condensador on es refreda i torna a estat líquid llest per ser recollit en un recipient. Aquesta tècnica s'utilitza
per separar els components del petroli ( querosé, benzina, quitrà, etc).
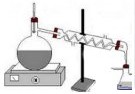 |
| Aparell de destil.lació |
|