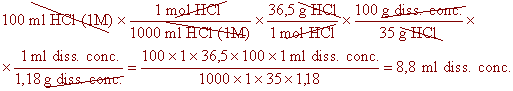| Començar
| Experiments | Galeria
de Fotos | Glossari | Jocs
| Pedagogia |
Sortir
|
|
|
|
| Passos per a resoldre problemes
de química |
| Per resoldre problemes a química hi ha dos punts molt importants
a tenir en compte: quines són les dades del problema i quina
és l'equació química (la reacció química)
que hi té a veure. |
|
| Dades
del problema |
| Quan resolem un problema de química hem de tenir molt clares
quines són les dades que el problema ens dóna. No podem estar
resolent el problema i aturar-nos per tornar a llegir l'enunciat cada cop
que ens sembla que ens fa falta una dada, i no sabem si disposem d'ella
o no. |
|
| Per tant, primer llegirem el problema de manera tranquil·la
(no ens cal entendre tot el problema en aquest moment), per tal d'extreure
de l'enunciat totes les dades que ens donen. Això ho farem escrivint,
en una columna i a l'esquerra de la pàgina, tots els nombres que
van apareixent a l'enunciat. Si aquesta dada té una lletra característica
(es correspon a una magnitud com la densitat, el volum, la massa, etc.),
hi escriurem aquesta lletra, un igual, i a continuació el nombre
corresponent. Si no en té, pensarem una abreviatura per tal d'identificar-la
posteriorment (per exemple, de dissolució concentrada a diss.
conc.). A allò que se'ns pregunta li assignarem igualment un símbol,
i després de l'igual hi posarem un interrogant. En el segon
problema que tractàvem a la secció sobre els factors
de conversió, aquesta recollida de dades tindria el següent
aspecte: |
|
| Quants mil·lilitres d'HCl concentrat al 35% en pes
necessitem pipetejar per aconseguir 100 ml d'una dissolució d'HCl
1M? Sabem que la densitat de l'HCl concentrat és de 1,35 g/ml i
la massa molar de l'HCl és de 36,5 g/mol. |
| Dades: |
VHCl conc = ?
[HCl] conc = 35 % en pes
VHCl dil = 100 ml
[HCl] dil = 1 M
d HCl conc. = 1,35 g/ml
MHCl = 36,5 g/mol |
|
|
| És important escriure el títol "dades" just al damunt
de la columna de dades, a més a més de separar-les amb una
ratlla vertical de la resolució del problema. D'aquesta manera les
tindrem ben a la vista i fàcilment localitzables cada cop que en
puguem necessitar alguna. |
|
| Fixem-nos que encara que parlem tota l'estona d'HCl, en realitat són
dues dissolucions diferents, amb propietats diferents (són mescles,
no substàncies pures), per tant les hem de diferenciar a l'hora
de posar les dades. |
|
| Per
on començar? |
| Moltes vegades els problemes de química es resolen malament
perquè no se sap per on començar, és a dir, quina
és la dada que ens permetrà encetar la tirallonga de factors
de conversió? |
|
| Hem de diferenciar clarament dos tipus de dades, que anomenarem, respectivament,
dades relatives i dades absolutes. Les primeres són aquelles
que es descriuen amb una fracció o un tant per cent: densitats,
concentracions, etc. Les segones són una quantitat "absoluta": grams,
mil·lilitres, mols... Generalment les dades relatives ens serviran
de factors de conversió, mentre que les dades absolutes seran
les candidates més fermes a ser la dada inicial a partir de la qual
resoldrem el problema. |
|
| En l'exemple anterior només hi ha una dada absoluta: mil·lilitres
d'àcid clorhídric diluït, per tant, començarem
per aquesta dada, i resoldrem el problema tal i com vam veure en la secció
dels factors de conversió: |
|
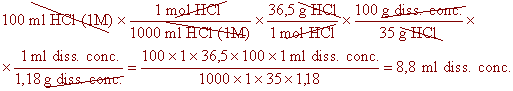
|
|
| Fixem-nos un cop més què n'és d'important el distingir
entre les dues dissolucions, per no incórrer en equivocacions i
fer servir dades corresponents a la dissolució concentrada com si
fossin de la diluïda i viceversa. |
|
| Com
acabar? |
|
| Moltes vegades se'ns oblida que en el problema ens estan preguntant
una cosa concreta, i que hem de respondre la pregunta de manera clara.
Així, no n'hi ha prou de realitzar les conversions corresponents
i deixar el resultat tal qual. Per finalitzar el problema hem de requadrar
el resultat, utilitzant el símbol que hem adjudicat a la
dada que ens preguntaven, seguit d'un igual, el valor que hem trobat i
les unitats corresponents. |
|
En l'exercici anterior, el resultat s'expressaria com:
|
VHCl conc = 7,7 ml HCldiss. conc
|
|
|
| Tot plegat hauria de tenir el següent aspecte: |
|
| Enunciat del problema |
| Dades |
Resolució del problema |
|
|
| solució = nombre (unitats) |
|
|
|
| Equació
química |
| Si el problema és un problema "químic" de bons segur
que ens apareixerà una reacció química, i el
problema serà de l'estil de : "calcula el nombre de mols que obtindrem
de la substància X si fem reaccionar tanta quantitat de la substància
A amb tal altra (quantitat) de la substància B". Probablement les
dues substàncies estiguin dissoltes, tinguin concentracions diferents....
en fi tot un embolic. |
| Esquema
a seguir quan hi ha una reacció química |
| |
|
Primer pas
|
|
|
Escriu l'equació química igualada del canvi químic.
|
|
|
|
|
Segon pas
|
|
|
Determina el nombre de mols amb les dades del problema.
|
|
|
|
|
Tercer pas
|
|
|
Utilitza la relació entre el nombre de mols, donada pels
coeficients de l'equació, per calcular el nombre de mols que et
demanen.
|
|
|
|
|
Quart pas
|
|
|
Converteix el nombre de mols en les magnituds requerides.
|
|
| Anem a veure un exemple: |
| Calcula quants grams d'hidròxid sòdic (NaOH)
es necessiten per neutralitzar 25 mil·lilitres d'una dissolució
d'àcid sulfúric (H2SO4) 1 M, sabent
que la massa molar de l'hidròxid sòdic és de 40 g/mol
i la de l'àcid sulfúric és de 98 g/mol. |
| Dades: |
Resolució: |
m NaOH = ? g
V(H2SO4 1M) = 25 ml
M(NaOH) = 40 g/mol
M(H2SO4)= 98g /mol |
| Primer pas: |
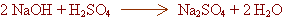 |
| segon pas: |
 |
| tercer pas: |
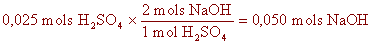 |
| quart pas: |
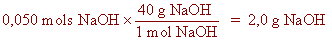 |
|
|
Solució:
|
|
|
| En aquest exemple hem calculat els valors parcials per tal de veure
cadascun dels passos que senyalàvem a l'esquema. Però
tret del primer pas (igualar la reacció química), podem encadenar
un factor de conversió rere l'altre i fer les operacions necessàries
al final. |
|
|
|
|
| Darrera actualització:
|