|
Experiments | Galeria
de Fotos | Glossari | Jocs
| Pedagogia |
Problemes
| Sortir |
|
|
|
| Les
dissolucions |
| Si mesclem aigua amb sal o aigua amb alcohol, obtenim un líquid
clar en el qual no podem distingir a ull nu o amb l'ajuda d'un microscopi
tots els components que hi són presents. Diem aleshores que la sal
i l'alcohol són solubles en aigua i la mescla preparada l'anomenem
dissolució.
Les substàncies que formen una dissolució
s'anomenen solut i dissolvent. El dissolvent és el component que
té el mateix estat físic de la dissolució (sòlid,
líquid o gasós), o el que hi és en major proporció
si tots dos estan en el mateix estat. El solut és el que està
en menor proporció. El els exemples anteriors l'aigua seria el dissolvent
i la sal o l'alcohol, el solut. |
|
| Una de les característiques de les dissolucions és que
són homogènies, és a dir, que qualsevol porció
de la dissolució té la mateixa composició, i per tant,
les mateixes propietats. Fixem-nos bé en la diferència amb
una reacció química: en formar una dissolució no es
trenquen enllaços per formar-ne de nous. |
|
| Importància
de les dissolucions aquoses |
| Les dissolucions aquoses són molt importants per al manteniment
de la vida. Així, les aigües continentals i subterrànies
són dissolucions que transporten substàncies dissoltes. Les
arrels de les plantes absorbeixen els nutrients directament del sòl,
prèviament dissolts en aigua (un dels motius per a regar les plantes).
Els aliments que prenem durant la digestió s'han de dissoldre abans
de poder passar a la sang i d'aquí a les cèl·lules. |
|
| Les dissolucions són útils per a les activitats industrial
i agrícola. Ens permeten eliminar substàncies no desitjades
de superfícies a partir de dissolvents adequats. La neteja en sec
utilitza el dissolvent tricloroetà per eliminar taques dels teixits. |
|
| Molts medicaments s'introdueixen en el cos a partir de la injecció
d'una dissolució que el conté. Les dissolucions permeten
transportar substàncies a llocs difícils d'arribar. Així,
per exemple, el sèrum fisiològic, una dissolució aquosa
de clorur de sodi (i d'altres substàncies), es fa servir per disoldre-hi
medicaments o aliments i introduir-los per via intravenosa. |
|
| Per extreure sal d'una mina s'hi introdueix aigua de manera que es
dissolgui la sal que hi ha; després es bombeja la dissolució
d'aigua amb sal i es treu a l'exterior per recuperar-ne la sal. |
|
| Les dissolucions també són útils per dispersar
de forma homogènia una substància sobre una gran superfície.
Els insecticides es dissolen per poder ser dispersats més fàcilment
sobre els conreus. Quan un pagès sulfata els seus conreus utilitza
un sulfatador que dispersa una solució aquosa de sulfat de coure.
Aquesta substància preserva les plantes dels efectes dels
fongs i d'altres paràsits (nosaltres la veiem en forma de un polsim
blau sobre els tomàquets, per exemple). |
|
| La
concentració de les dissolucions |
| Per descriure una dissolució cal conèixer els components
que la formen i la proporció en que es troben. La concentració
d'una dissolució expressa la quantitat de solut que es troba dissolt
en una determinada quantitat de dissolució. |
|
| Una dissolució diluïda conté
una quantitat de solut molt petita comparada amb la quantitat de dissolvent.
Una dissolució concentrada conté una quantitat molt gran
de solut respecte de la quantitat de dissolvent. A la dreta podem veure
dos exemples de dissolucions, una de diluïda i una de concentrada
de les mateixes substàncies: sulfat de coure (II) en aigua. Fixem-nos
que la dissolució diluïda presenta un color blau més
clar que la concentrada |

Dissolució
diluïda |

Dissolució
concentrada |
|
|
| Les unitats que s'utilitzen més freqüentment per expressar
la concentració d'una dissolució són: Percentatge
en massa, percentatge en volum, grams per litre i mols per litre o molaritat. |
|
El percentatge en massa (% en massa): Expressa els grams
de solut per cent grams de dissolució (no de dissolvent!).
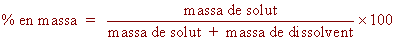
|
|
El percentatge en volum (% en volum): Expressa el volum
de solut (litres, m3 cc, ml, etc...) que es troba dissolt en
100 volums de dissolució. Aquesta unitat s'utilitza per dissolucions
on el solut és líquid o gas.
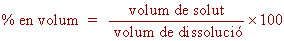
|
|
Els grams per litre (g/l): expressen els grams de solut
que es troben dissolts en un litre de dissolució. S'acostuma a utilitzar
quan el solut és sòlid i el dissolvent és líquid.

|
|
Molaritat (M): expressa el nombre de mols de solut que
es troben dissolts en un litre de dissolució. És la més
habitual en els laboratoris de química. El dissolvent acostuma a
ser líquid.
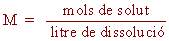
|
|
|
|
| Darrera actualització:
|

