| | Experiments
| Galeria de Fotos | Glossari
| Jocs | Pedagogia |
Problemes
| Sortir | |
|
|
| L'estructura
de l'àtom |
| Fins fa poc més d'uns cent anys es creia que la part més
petita que es podia obtenir de la matèria era l'àtom. Avui
dia ja sabem que hi ha partícules més petites, com l'electró,
el
protó i el
neutró. D'altra banda, aquestes partícules es localitzen
dins l'àtom en dues zones ben diferenciades: el
nucli i
l'escorça. D'allò que passa al nucli se n'ocupa la Física
Nuclear, mentre que d'allò que ocorre a l'escorça se
n'ocupa la Química Quàntica,
ja que són els
electrons els que intervenen en les reaccions
químiques. |
|
| Davant la impossibilitat de disposar d'aparells d'observació
directa de l'àtom, a causa de les seves dimensions tant reduïdes,
els científics han ideat models que tracten de representar i d'explicar
com estan organitzats els electrons a l'escorça. Segons el model
del que disposem actualment (model mecànico-ondulatori), els electrons
no es troben situats a l'atzar, sinó que ocupen espais determinats,
de formes diferents, anomenats orbitals. |
|
| En conjunt, l'escorça d'un àtom pot comparar-se a un
edifici de diverses plantes i amb diversos habitatges a cada planta. Les
plantes d'aquest "edifici atòmic" s'anomenen capes o nivells electrònics,
i els habitatges de cada planta són els orbitals. A cada orbital
només hi caben dos electrons, però el nombre d'habitatges
per planta (el nombre d'orbitals per nivell) varia d'una planta (nivell)
a una altra. |
|
| Diferenciació
dels elements |
Si els àtoms dels 114 elements tenen nucli i escorça,
què és el que els diferència els uns dels altres?
Per identificar els àtoms dels elements hem de fixar-nos en el nombre
de protons. Per exemple:
-Si un àtom té 1 protó és un àtom
d'hidrogen
-Si un àtom té 8 protons és un àtom d'oxigen.
El nombre de protons d'un àtom s'anomena nombre atòmic,
es representa amb la lletra Z i és com el seu "carnet d'identitat".
Com l'àtom és elèctricament neutre, tindrà
el mateix nombre d'electrons que de protons, però si és un
ió
aquests no tenen perquè coincidir. |
|
| La suma del nombre de protons i neutrons s'anomena nombre màssic
i
es representa amb la lletra A. Pot haver-hi àtoms d'un mateix
element amb un nombre diferent de neutrons (no de protons!), i per
tant, amb nombre màssic diferent: són els isòtops. |
|
| La
massa relativa dels àtoms |
| Els valors de massa absoluta dels àtoms (el valor que obtindríem
si poguéssim pesar-los en una balança) estan molt allunyats
de les nostres dimensions i resulten poc pràctics per al treball
quotidià en química, és molt més útil
treballar amb les masses relatives dels àtoms. Suposem que la massa
d'un protó val 1. Llavors, un àtom d'hidrogen, constituït
per un protó i un electró, tindrà la massa igual a
1. Un àtom d'oxigen, composat per 8 protons i 8 neutrons, tindrà
una massa igual a 16. (es pot considerar que les masses dels neutrons i
dels protons són iguals i que la massa de l'electró, respecte
a aquests, és nul·la). |
|
| En el cas dels elements que tenen dos o més isòtops,
trobem
la massa relativa de l'element fent la mitja ponderada de les masses relatives
de cada isòtop. a la taula
periòdica dels elements ja ens apareixen aquestes masses ponderades.
Així, un element com el clor (Cl) té dos isòtops,
un format per 17 protons i 18 neutrons i un altre format per 17 protons
i 19 neutrons. La massa relativa de cada isòtop, és doncs,
35 i 36 respectivament. Donat que a la naturalesa apareixen en igual proporció,
diem que la massa relativa del clor és de 35,5. En d'altres casos,
un dels isòtops és majoritari, sent així que la massa
de l'element s'assemblarà molt a la de l'isòtop més
abundant. L'oxigen té dos isòtops, un que té 8 protons
i 8 neutrons (massa relativa = 16) i un altre que té 8 protons i
7 neutrons (massa relativa = 15). Donat que l'isòtop majoritari
és el primer, amb una proporció de 1000:1 la massa relativa
de l'oxigen val 15,999. |
|
Per calcular la massa relativa d'una molècula seguim un procediment
similar on, en lloc de sumar protons i neutrons, sumem les masses relatives
dels àtoms que les componen. Vegem dos exemples:
La massa relativa corresponent a una molècula d'òxid
de magnesi (MgO) serà igual a la suma de les masses corresponents
a un àtom de magnesi més la massa corresponent a un àtom
d'oxigen (arrodonim 15,999 a 16), és a dir, 24 + 16 = 40.
La massa relativa d'una molècula de diòxid de carboni
(CO2) serà igual a la suma de les masses corresponents
a un àtom de carboni més dues vegades la massa d'un
àtom d'oxigen (n'hi ha dos): 12 + 2·16 = 44.
Fixem-nos bé en el fet que sumem les masses de tots els àtoms
presents a la molècula, encara que estiguin repetits. |
|
| El concepte
de mol |
|
Un àtom de carboni (6 protons i 6 neutrons) té una massa
12 vegades més gran que la massa d'un àtom d'hidrogen (1
protó). Sempre que tinguem el mateix nombre d'àtoms de carboni
que d'hidrogen la relació de masses serà de 12:1.
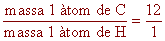
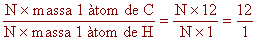
A partir d'aquesta relació, tindrem que un gram d'hidrogen
conté el mateix nombre d'àtoms que 12 grams de carboni. Per
tant, si en un gram d'hidrogen hi ha 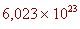 àtoms
d'hidrogen, llavors el mateix nombre d'àtoms de carboni, (és
a dir àtoms
d'hidrogen, llavors el mateix nombre d'àtoms de carboni, (és
a dir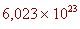 )
pesarà 12 grams. Com que la massa d'una molècula és
la suma de les masses dels àtoms que la formen, )
pesarà 12 grams. Com que la massa d'una molècula és
la suma de les masses dels àtoms que la formen, 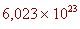 molècules
d'aigua (H2O) pesaran 2 grams d'hidrogen més els
16 grams d'oxigen, és a dir, 18 grams. molècules
d'aigua (H2O) pesaran 2 grams d'hidrogen més els
16 grams d'oxigen, és a dir, 18 grams. |
|
| Sovint necessitem conèixer la quantitat de matèria que
ha intervingut en una reacció química. Però per treballar
amb àtoms o molècules individuals representa treballar amb
nombres molt grans, ja que per petita que sigui la massa, sempre conté
una gran quantitat d'àtoms. Per això els químics han
adoptat una unitat per a la quantitat de matèria: el
mol. La massa d'un mol s'anomena massa
molar, i dependrà del tipus de substància que formi el
mol. |
|
En el cas dels elements químics, la massa molar coincideix
amb la massa atòmica relativa, que trobarem a la taula periòdica,
expressada en grams. En el cas dels compostos químics, és
simplement la suma de les masses atòmiques relatives dels àtoms
presents a la molècula. Fixem-nos que per calcular la massa molar
simplement hem de trobar les masses relatives de l'àtom o molècula
i a continuació afegir "grams"!
Exemples:
| Compost |
massa relativa |
massa molar |
| FeS |
55.9 + 32.1 = 88.0 |
88.0 g |
| H2O |
2.0 + 16.0 = 18.0 |
18.0 g |
| NaCl |
23.0 + 35.5 = 58.5 |
58.5 g |
|
|
| Reaccions
químiques |
| Els canvis químics que es produeixen en les substàncies
poden ser molt diferents: des de l'espectacular explosió dels focs
artificials fins a la lenta acció de l'oxigen per rovellar un clau
de ferro. Però tots tenen una característica comuna: l'obtenció
de substàncies diferents de les inicials. D'aquest procés
de canvi se'n diu reacció
química. |
|
| En l'apartat "àtoms i molècules"
hem esmentat que les substàncies estan formades per molècules,
que són conjunts d'àtoms enllaçats entre sí.
Si en una reacció química desapareixen unes substàncies
per a formar-se'n de noves, vol dir que els enllaços que hi havia
inicialment entre els àtoms s'han trencat per formar-se'n de nous.
Així doncs: |
|
| En una reacció química es trenquen els enllaços
de les substàncies inicials (reactius) i es formen altres enllaços
que donen lloc a les noves substàncies (productes). |
|
| Una manera simple de representar els canvis que tenen lloc durant una
reacció química és fer-ho en forma d'equació
química:
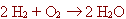
Els símbols de les substàncies que queden a l'esquerra
de la fletxa són els reactius o substàncies inicials. Les
substàncies que queden a la dreta són els productes o substàncies
que es formen. El signe + entre els reactius significa "reacciona amb"
i la fletxa vol dir "per produir". Aquesta equació es llegeix de
la manera següent: " l'hidrogen reacciona amb l'oxigen per produir
aigua". |
|
| Com
identificar reaccions químiques |
Quan observem una reacció química podem veure diversos
canvis: un canvi de color, un despreniment o absorció d'energia,
normalment en forma de calor o llum..., una producció d'un gas que
no és el resultat de l'ebullició d'un líquid, la formació
d'un polsim (anomenat precipitat) quan dos líquids es barregen,
etc. Aquestes variacions són provocades pel canvi de reactius a
productes, ja que uns i altres tenen propietats diferents.
Aquí us presentem algunes fotografies de canvis químics
fetes al laboratori:
Canvi de color
Formació d'un
precipitat
Despreniment d'energia
en forma de llum
Canvi de volum |
|
| Si voleu provar de fer algunes reaccions químiques a casa, visiteu
la pàgina:
Experiments
per fer a casa
|
|
|
|
| Darrera actualització:
|
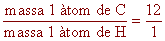
![]()